
 ,易失去最外层一个电子.则锂的氧化物的化学式为 .
,易失去最外层一个电子.则锂的氧化物的化学式为 .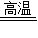 N2↑+Cl2↑+4 ↑+2O2↑
N2↑+Cl2↑+4 ↑+2O2↑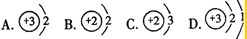
 N2↑+Cl2↑+4( )↑+2O2↑,推断反应中生成物( )的分子构成,然后确定物质的化学式.
N2↑+Cl2↑+4( )↑+2O2↑,推断反应中生成物( )的分子构成,然后确定物质的化学式. ×100%=6.4g,水中氧元素的质量为:3.6g×
×100%=6.4g,水中氧元素的质量为:3.6g× ×100%=3.2g,所以二氧化碳和水中所含氧元素的总质量为:6.4g+3.2g=9.6g>7.2g,所以结合质量守恒定律的实质可以得出在该物质中一定含氧元素.
×100%=3.2g,所以二氧化碳和水中所含氧元素的总质量为:6.4g+3.2g=9.6g>7.2g,所以结合质量守恒定律的实质可以得出在该物质中一定含氧元素.

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
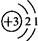 ,易失去最外层一个电子.则锂的氧化物的化学式为
,易失去最外层一个电子.则锂的氧化物的化学式为查看答案和解析>>
科目:初中化学 来源: 题型:
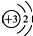 ,在反应中易
,在反应中易查看答案和解析>>
科目:初中化学 来源: 题型:
 ,易失去最外层一个电子.则锂的氧化物的化学式为
,易失去最外层一个电子.则锂的氧化物的化学式为
| ||
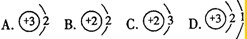
查看答案和解析>>
科目:初中化学 来源: 题型:
 易失去最外层一个电子.则锂的氧化物的化学式为
易失去最外层一个电子.则锂的氧化物的化学式为查看答案和解析>>
科目:初中化学 来源:2006年广东省揭阳市中考化学试卷(课改区)(解析版) 题型:解答题
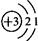 ,易失去最外层一个电子.则锂的氧化物的化学式为______.
,易失去最外层一个电子.则锂的氧化物的化学式为______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com