
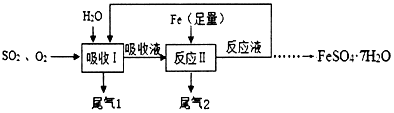
分析 (1)根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前各原子的数目之和等于反应后各原子的数目之和,据此可推断X的化学式,根据温度对气体溶解度的影响来分析;
(2)根据铁与硫酸反应生成硫酸亚铁和氢气写出化学方程式;
(3)根据加快化学反应速率的措施来分析;
(4)根据分离混合物的方法以及贫血可能缺少铁元素造成的来解答.
解答 解:(1)反应前S:2,O:8,H:4,反应后一个X分子的组成为2个氢原子、1个硫原子、4个氧原子,故化学式为:H2SO4;温度越高,气体的溶解度越小,所以I中用水吸收时为了提高SO2和O2的吸收效率,温度不宜过高;故填:H2SO4;高;
(2)铁与硫酸反应生成硫酸亚铁和氢气的写出化学方程式为:Fe+H2SO4=FeSO4+H2↑;故填:Fe+H2SO4=FeSO4+H2↑;
(3)为确保反应液的循环吸收效果,吸收液与铁的反应需控制在40℃左右进行,在此条件下可以使用铁粉(或搅拌或使用催化剂)来加快该反应速率;吸收液中X的生成速率明显加快,其原因可能是生成的硫酸亚铁(或Fe2+)对亚硫酸氧化生成硫酸的反应起催化作用,故填:使用铁粉(或搅拌或使用催化剂);生成的FeSO4(或Fe2+)起催化作用;
(4)从溶液中分离出晶体,采用过滤的方法,FeSO4•7H2O中含铁元素,可治疗贫血症,而A与碘元素有关,B与钙元素有关,C与氟元素有关,故答案为:过滤;D.
点评 本题为信息题,考查学生分析与应用知识的能力,涉及影响反应速率的因素、质量守恒定律、化学与生活等,综合性较强,题目难度不大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
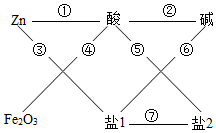 稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化
稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化查看答案和解析>>
科目:初中化学 来源: 题型:解答题
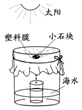 水是重要资源.
水是重要资源.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲>乙>丙>丁 | B. | 乙>甲>丙>丁 | C. | 丁>丙>乙>甲 | D. | 乙>甲>丁>丙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ⑤④②①③ | D. | ⑤②④③① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com