
 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.分析 (1)根据固体物质的溶解度曲线可以比较不同物质在同一温度下的溶解度大小;
(2)据溶解度曲线可知物质的溶解度随温度变化情况,并分析提纯物质的方法;
(3)据该温度下a的溶解度分析解答;
(4)据物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数分析解答.
解答 解:(1)t1℃时,a、b、c三种物质的溶解度的大小关系是b>a=c;
(2)a的溶解度随温度升高而增大,且变化较大,c 的溶解度随温度升高而减小,所以a物质中含有少量的c,若提纯a,可采用冷却热饱和溶液或降温结晶的方法;
(3)t2℃时a的溶解度是50g,即100g水中最多溶解50g的a,所以将30g a物质放入50g水中,最多溶解25g,形成75g溶液;
(4)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃后,a、b溶解度减小,仍为饱和溶液,且b的溶解度大于a的溶解度,c的溶解度变大,变为不饱和溶液,溶液中溶质、溶剂的质量不变,与降温前相等,而t1℃时a的溶解度大于降温前c的溶解度,饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大,故三种溶液的溶质质量分数大小关系 b>a>c;
故答案为:(1)b>a=c;(2)冷却热饱和溶液(或降温结晶);(3)75;(4)b>a>c.
点评 解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液溶质质量分数的计算,知道溶解度的含义.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
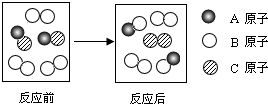
| A. | 该反应前后分子的种类和数目一定改变 | |
| B. | 该反应的生成物都属于氧化物 | |
| C. | 参加反应的A、B、C各原子的个数比为1:2:2 | |
| D. | 该反应的基本类型为置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 ”代表氢原子,“
”代表氢原子,“ ”代表氮原子,“
”代表氮原子,“ ”代表氧原子),下列叙述中,正确的是( )
”代表氧原子),下列叙述中,正确的是( )
| A. | 该反应类型为置换反应 | |
| B. | 该反应中氧元素的化合价发生了变化 | |
| C. | 所得生成物Z和W的质量比为9:15 | |
| D. | 该反应中原子、分子种类都未发生变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
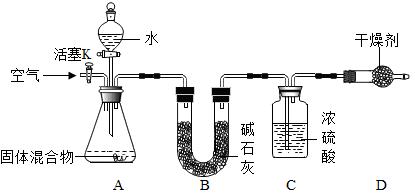
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物 | |
| B. | 单质只含一种元素,所以含一种元素的纯净物一定是单质 | |
| C. | MnO2能加快H2O2分解的速率,所以MnO2一定能加快其它物质分解的速率 | |
| D. | 在同一化合物中金属元素显正价,所以非金属元素一定显负价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com