

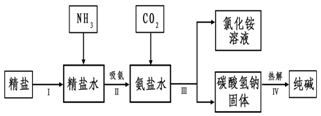
分析 (1)从海水中获取淡水.常用的操作方法是蒸馏;
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;
正确的操作顺序是过滤除去泥沙、加过量的NaOH溶液除去硫酸镁、加过量的BaCl2溶液除去反应生成的硫酸钠、加过量的Na2CO3溶液除去氯化钙和过量的氯化钡,加入适量稀盐酸除去过量的氢氧化钠和碳酸钠;
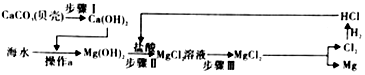
(3)上述过程中,沉淀B是氢氧化镁,试剂C是稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水;
(4)氨盐水显碱性,pH大于7;相同条件下,物质的溶解度越小,越容易从溶液中析出.
解答 解:(1)从海水中获取淡水.常用的操作方法是蒸馏.
故填:蒸馏.
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;
正确的操作顺序是过滤除去泥沙、加过量的NaOH溶液除去硫酸镁、加过量的BaCl2溶液除去反应生成的硫酸钠、加过量的Na2CO3溶液除去氯化钙和过量的氯化钡,加入适量稀盐酸除去过量的氢氧化钠和碳酸钠.
故填:蒸发;①②⑤④③.
(3)上述过程中,沉淀B是氢氧化镁,试剂C是稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水,属于中和反应,发生的反应化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O;
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液的不同之处在于:通过步骤①、②得到的氯化镁溶液中氯化镁的质量分数比海水中氯化镁的质量分数大.
故填:Mg(OH)2+2HCl═MgCl2+2H2O;通过步骤①、②得到的氯化镁溶液中氯化镁的质量分数比海水中氯化镁的质量分数大.
(4)吸氨,就是NH3气溶于水得到氨盐水,氨盐水显碱性,溶液的pH大于7;
工业生产纯碱的流程中,碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是相同条件下,碳酸钠的溶解度大于碳酸氢钠的溶解度.
故填:大于;相同条件下,碳酸钠的溶解度大于碳酸氢钠的溶解度.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳可用作气体肥料 | |
| B. | 一氧化碳、二氧化碳都能还原氧化铁 | |
| C. | 木炭的吸附作用比活性炭强 | |
| D. | 一氧化碳是形成酸雨的罪魁祸首 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 点燃某可燃物,在火焰上罩一个冷而干燥的烧杯,烧杯的内壁有水雾出现,则可燃物一定是H2或含有H2 | |
| B. | 某混合气体能使灼热的氧化铜变成红色固体,且导出后气体能使澄清石灰水变浑浊,证明原气体中一定含有一氧化碳 | |
| C. | 实验室不用稀硫酸和石灰石制取二氧化碳的原因是,两者无法反应 | |
| D. | 实验室用大理石与盐酸反应制取的CO2通入澄清石灰水无沉淀生成可能是因为盐酸太浓 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④③ | B. | ①④②③ | C. | ④①②③ | D. | ②③①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com