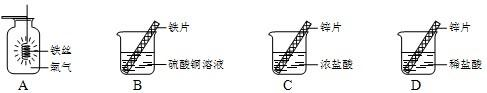
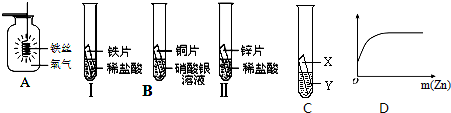
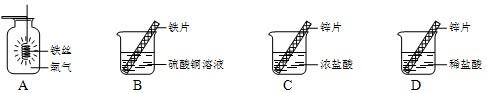
解:(1)铁在氧气中燃烧的主要实验现象是 火星四射,生成黑色固体,化学方程式为 3Fe+2O
2
Fe
3O
4.
(2)在金属活动性顺序中,铁比铜活泼,所以铁能置换出硫酸铜中的铜,反应的化学方程式为 CuSO
4+Fe═Cu+FeSO
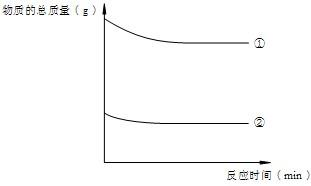
4(3)(Ⅰ)锌是等质量的,浓盐酸和稀盐酸是等体积的,但浓盐酸的密度大,所以质量大,故 ①曲线表示锌与浓盐酸反应.
(Ⅱ)曲线①②表示的质量起点不同是因为等体积的浓盐酸和稀盐酸的质量不同,曲线①改变幅度大主要是因为与浓盐酸反应的锌的质量大,放出的氢气多,另外和浓盐酸的挥发性也有关系.
答案:(1)火星四射,生成黑色固体 3Fe+2O
2
Fe
3O
4
(2)CuSO
4+Fe═Cu+FeSO
4 强
(3)(Ⅰ)①
(Ⅱ)实验C的起始总质量大于实验D,因为浓盐酸和稀盐酸的体积相同,但密度浓盐酸大于稀盐酸,浓盐酸的质量大于稀盐酸.实验C对应的曲线质量较实验D下降得多,因为等体积的浓盐酸中的溶质的含量大于稀盐酸,所以与过量锌反应产生的氢气浓盐酸比稀盐酸多,质量减轻多;又因为浓盐酸的挥发性比稀盐酸强,反应中由于挥发造成的质量减少也比稀盐酸大
分析:图A、B主要从铁的化学性质来解答,铁能在氧气中燃烧,能与活动性比铁弱的金属的盐溶液反应.图C、D要从锌的性质和酸的性质来解答,反应物的浓度决定反应进行的速度及程度.浓盐酸中溶质含量多,有挥发性.
点评:本题全面考查了金属与氧气,金属与盐溶液,金属与酸反应时的现象,化学方程式,影响因素等方面的知识点.


 Fe3O4.
Fe3O4. Fe3O4
Fe3O4