
| A. |  | B. |  | C. |  | D. |  |
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:选择题
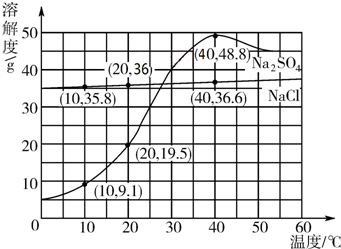
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢气和液氢都可以做燃料--相同物质的分子,化学性质相同 | |
| B. | 用警犬搜救地震中被埋人员--分子在不断运动 | |
| C. | 用水银温度计测量体温--温度升高,原子间隔变大 | |
| D. | 水烧开后把壶盖冲起--温度升高,分子变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
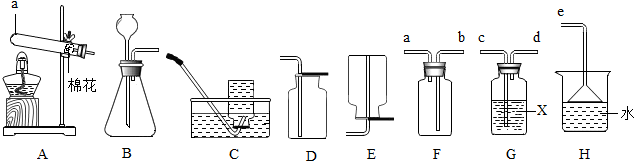
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
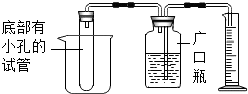 小科在学习了金属的化学性质后,想对锌、铜合金中锌的质量分数进行粗略测定.在老师的指导下,他设计了如图所示的实验装置,并选用了三种试剂:A.蒸馏水 B.锌、铜合金 C.稀硫酸.根据小科的实验思路,请你思考:
小科在学习了金属的化学性质后,想对锌、铜合金中锌的质量分数进行粗略测定.在老师的指导下,他设计了如图所示的实验装置,并选用了三种试剂:A.蒸馏水 B.锌、铜合金 C.稀硫酸.根据小科的实验思路,请你思考:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
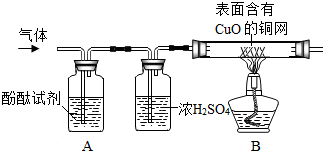
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
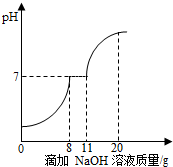 在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),同学们做了如下实验:取10g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系.
在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),同学们做了如下实验:取10g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com