实验室用高锰酸钾来制取氧气.经探究,生成氧气的质量约是高锰酸钾质量的1/10.
(1)现有高锰酸钾8.9g,大约能生成氧气的质量是多少?
(2)这些氧气若装在容积为125mL的集气瓶中,需要几个集气瓶?(氧气在该条件下的密度为1.43g/L)
【答案】
分析:(1)根据题目是的已知信息“经探究,生成氧气的质量约是高锰酸钾质量的 110.”可由高锰酸钾的质量求出大约生成氧气的质量;
(2)根据(1)中求出的氧气质量,利用密度公式可以求出氧气的体积,然后根据集气瓶的容积再换算成瓶数即可,注意要单位要统一.
解答:解:(1)由题意可以知道,生成氧气的质量约是高锰酸钾质量的

;
所以可以得出高锰酸钾8.9g,大约能生成氧气的质量是:8.9g×

=0.89g;
(2)由公式m═ρv可知:v═
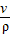
可求出氧气的体积:0.89g÷1.43g/L=0.6224L=622.4mL
可装的瓶数:622.4mL÷125mL/瓶=4.98瓶
所以需要5个集气瓶;
答:(1)大约能生成氧气的质量是0.89g;
(2)这些氧气若装在容积为125 mL的集气瓶中,需要5个集气瓶.
点评:本题考查的内容较简单,需要指出的是:①根据题意来求生成氧气的质量,而非根据化学方程式来求解;②注意单位运算时的统一.

 ;
; =0.89g;
=0.89g;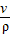 可求出氧气的体积:0.89g÷1.43g/L=0.6224L=622.4mL
可求出氧气的体积:0.89g÷1.43g/L=0.6224L=622.4mL