
| 物质 | 氯化氢 | 盐酸 | 氢氧化钙 | 石灰水 | 氯化钠 | 食盐水 |
| 组成元素 | H、Cl | H、Cl、O | Ca、H、O | Ca、H、O | Na、Cl | Na、Cl、H、O |
| 构成粒子 | HCl | HCl、H2O | Ca2+、OH- | Ca2+、OH-、H2O | Na+、Cl- | Na+、Cl-、H2O |
分析 (1)根据物质是由元素组成的,构成微粒有离子、分子等,依据具体的物质进行分析;
(2)①根据不同种类的物质具有不同的性质,这是因为构成物质的微粒不同进行分析;
②根据乙醇的组成和碱的定义进行分析;
(3)①根据盐酸、石灰水、食盐水分别属于酸、碱、盐进行分析;
②根据盐酸和氧化铁反应生成氯化铁和水进行分析;
③根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析;
④根据氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠进行分析;
(4)①根据氯化钠溶液在通电的条件下生成氢氧化钠、氢气和氯气,氯气和氢气在点燃的条件下生成氯化氢进行分析;
②根据饱和溶液的定义进行分析;
③根据燃烧的定义进行分析.
解答 解:(1)氯化氢是由氢元素H和氯元素Cl组成的,是由氯化氢分子HCl构成的;
盐酸是氯化氢的水溶液,组成元素为氢元素H和氯元素Cl还有氧元素O,是由氯化氢分子HCl和水分子H2O构成的;
氢氧化钙是由钙元素Ca、氢元素H、氧元素O组成的,是由钙离子Ca2+和氢氧根离子OH-构成的;
石灰水是氢氧化钙的水溶液,是由钙元素Ca、氢元素H、氧元素O组成的,是由钙离子Ca2+、OH-和水分子H2O构成的;
氯化钠是由钠元素Na和氯元素Cl组成的,是由钠离子Na+和氯离子Cl-构成的;
食盐水是氯化钠的水溶液,是由钠元素Na、氯元素Cl、氢元素H、氧元素O组成的,是由钠离子Na+和氯离子Cl-和水分子H2O构成的;所以
| 物质 | 氯化氢 | 盐酸 | 氢氧化钙 | 石灰水 | 氯化钠 | 食盐水 |
| 组成元素 | H、Cl | H、Cl、O | Ca、H、O | Ca、H、O | Na、Cl | Na、Cl、H、O |
| 构成粒子 | HCl | HCl、H2O | Ca2+、OH- | Ca2+、OH-、H2O | Na+、Cl- | Na+、Cl-、H2O |
| 物质 | 氯化氢 | 盐酸 | 氢氧化钙 | 石灰水 | 氯化钠 | 食盐水 |
| 组成元素 | H、Cl | H、Cl、O | Ca、H、O | Ca、H、O | Na、Cl | Na、Cl、H、O |
| 构成粒子 | HCl | HCl、H2O | Ca2+、OH- | Ca2+、OH-、H2O | Na+、Cl- | Na+、Cl-、H2O |
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.


科目:初中化学 来源: 题型:选择题
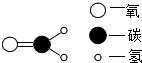 优质糯米胶绿色环保,其中因不含甲醛而减少了装修的污染.甲醛的分子结构如图所示,下列表述不正确的是( )
优质糯米胶绿色环保,其中因不含甲醛而减少了装修的污染.甲醛的分子结构如图所示,下列表述不正确的是( )| A. | 甲醛由三种元素组成 | |
| B. | 甲醛是一种有机化合物 | |
| C. | 甲醛的相对分子质量为30g | |
| D. | 甲醛中碳、氢、氧元素的质量比为6:1:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 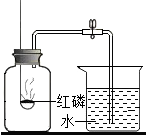 空气中氧气含量的测定 | B. | 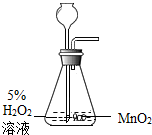 氧气的制取 | ||
| C. | 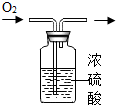 氧气的干燥 | D. | 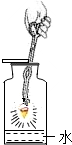 铁丝在氧气中燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
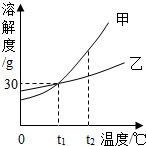 如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,请据图回答问题:
如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,请据图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
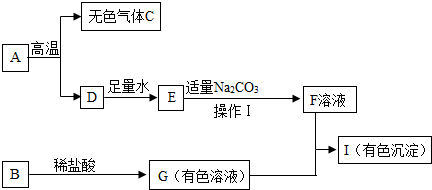
 A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
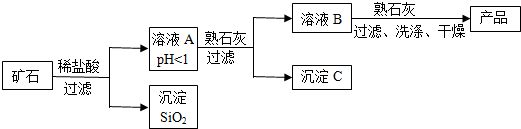
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  栽种秧苗 | B. |  收割水稻 | C. |  稻谷晾晒 | D. |  稻草发电 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 向盛有100g不饱和Na2CO3溶液的烧杯中,滴入一定量的BaCl2溶液至恰好完全反应,然后过滤,将得到的固体物质放入烧杯中,并向其中逐滴滴入溶质质量分数为10%的稀盐酸,烧杯中难溶物质的质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答下列问题:
向盛有100g不饱和Na2CO3溶液的烧杯中,滴入一定量的BaCl2溶液至恰好完全反应,然后过滤,将得到的固体物质放入烧杯中,并向其中逐滴滴入溶质质量分数为10%的稀盐酸,烧杯中难溶物质的质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com