
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | 4.7g |
| 第二次加入10g | m g |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.2g |
| 第五次加入10g | 1.2g |
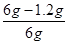 ×100%=80%。
×100%=80%。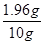 ×100%=19.6%。
×100%=19.6%。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:初中化学 来源:不详 题型:计算题
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
| 剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 盖中盖高钙片 【主要原料】碳酸钙、维生素D 【功效成分】每片含:钙500mg、维生素D100IU 【用法用量】每日1片,嚼食。 【适宜人群】需要补钙者。 【注意事项】 1、本品不能代替药物。 2、不宜超过推荐量或与同类营养素补充剂同时食用。 【规格】2.5g×36片 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
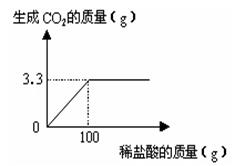
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.生成2.0 gCO2气体 | B.原来CaCO3的质量为14.3 g |
| C.生成了5.6 gCaO | D.剩余CaCO3的质量为3.0 g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯和烧杯内物质的总质量/g | 132.8 | 170.6 | 208.4 | 246.2 | 286.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com