BD
分析:方法一:根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出Na
2CO
3和NaHCO
3分别与足量的盐酸反应的化学方程式;根据化学方程式分别找出Na
2CO
3与二氧化碳气体的质量比,NaHCO
3与二氧化碳气体的质量比,由Na
2CO
3和NaHCO
3的质量可表示出生成的二氧化碳气体质量;同样CaCO
3和KHCO
3、NaHCO
3和碳酸镁、Na
2CO
3和MgCO
3来比较生成二氧化碳气体的质量大小;总结快速解此类题的规律.
方法二:分别计算Na
2CO
3和NaHCO
3、CaCO
3和KHCO
3、NaHCO
3和碳酸镁、Na
2CO
3和MgCO
3的相对分子质量,则可知等质量的以上物质,则可比较含有的微粒多少;因为二氧化碳来自碳酸根或碳酸氢根,则微粒多,生成二氧化碳多;故只要计算出相对分子质量,则可知答案.
解答:方法一:设Na
2CO
3和NaHCO
3的质量都为a,a克Na
2CO
3与足量的盐酸反应,生成的二氧化碳气体的质量为x,a克NaHCO
3与足量的盐酸反应,生成的二氧化碳气体的质量为y.
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
106 44
a x
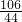
═
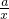
x=

NaHCO
3+HCl═NaCl+H
2O+CO
2↑
84 44
a y
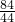
═
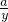
y=


<

同样,CaCO
3和KHCO
3、NaHCO
3和碳酸镁、Na
2CO
3和MgCO
3的;则找出的规律是:这四种物质分别与相同质量足量的稀盐酸反应时,谁的相对分子质量越小生成的二氧化碳气体就最多,谁的相对分子质量越大生成的二氧化碳气体就最少.
故选B、D.
解:方法二:分别计算Na
2CO
3和NaHCO
3、CaCO
3和KHCO
3、NaHCO
3和碳酸镁、Na
2CO
3和MgCO
3的相对分子质量,则可知等质量的以上物质,则可比较含有的微粒多少;因为二氧化碳来自碳酸根或碳酸氢根,则微粒多,生成二氧化碳多;故只要计算出相对分子质量,则分别与相同质量足量的稀盐酸反应时,谁的相对分子质量越小生成的二氧化碳气体就最多,谁的相对分子质量越大生成的二氧化碳气体就最少.
故选B、D.
点评:做本类型题时若要用常规方法做的话将非常复杂,计算起来比较麻烦,我们可以从反方向进行分析,问用等质量下列各物质分别与足量稀盐酸反应后,生成CO
2量最多的是哪一种,我们可以将问题转化为:得到等质量的二氧化碳哪一种物质用的最少.本题主要考查化学方程式的书写和有关化学方程式的计算,计算要细心、准确,善于总结解题规律和方法,寻找解题捷径.

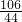 ═
═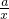

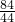 ═
═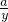

 <
<

