
【题目】小明用如图1装置测定空气中氧气的体积分数.请你结合实验完成下列各题:

(1)燃烧匙内放有红磷。该物质燃烧时的现象是__________,反应的表达式为___________。通过对________________ 的实验现象进行分析,从而得出空气中氧气的含量的实验结论。
(2)由本实验还可以推知瓶内剩余气体的哪一性质?试写出其中一种________________。
(3)若实验后发现测定出空气中氧气的体积分数小于![]() ,则可能的原因有哪些?(写2条)①____,②________。
,则可能的原因有哪些?(写2条)①____,②________。
(4)若将红磷换成木炭,该实验能否获得成功?理由是_____________________。
(5)图2是小花对实验的改进装置:
小花用白磷代替红磷燃烧进行实验,(查阅资料:白磷的着火点是40![]() )。实验的主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图2连好仪器,按下热的玻璃棒,白磷立即被点燃。
)。实验的主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图2连好仪器,按下热的玻璃棒,白磷立即被点燃。
(6)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是________________________;
若实验非常成功,最终集气瓶中水的体积约为_____mL。
(7)集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?_____(填写序号)
A.冷却集气瓶 B.液封导管末端以防气体逸出 C.缓冲集气瓶内气压的骤然升高
【答案】产生大量白烟,放出热量红磷+氧气![]() 五氧化二磷烧杯的水沿着导管进入集气瓶中约占瓶内空气体积的1/5难溶于水或不能燃烧也不支持燃烧红磷不足装置漏气不成功,因为木炭燃烧生成二氧化碳气体,瓶内气压没有明显变化,所以不成功先下降后上升70mlABC
五氧化二磷烧杯的水沿着导管进入集气瓶中约占瓶内空气体积的1/5难溶于水或不能燃烧也不支持燃烧红磷不足装置漏气不成功,因为木炭燃烧生成二氧化碳气体,瓶内气压没有明显变化,所以不成功先下降后上升70mlABC
【解析】
(1)红磷和氧气反应生成五氧化二磷,现象为产生大量白烟,放出热量;该反应的文字表达式为红磷+氧气![]() 五氧化二磷;实验中消耗氧气的体积等于进入集气瓶中水的体积,故通过对烧杯的水沿着导管进入集气瓶中约占瓶内空气体积的1/5的实验现象进行分析,可得出空气中氧气的含量的实验结论;
五氧化二磷;实验中消耗氧气的体积等于进入集气瓶中水的体积,故通过对烧杯的水沿着导管进入集气瓶中约占瓶内空气体积的1/5的实验现象进行分析,可得出空气中氧气的含量的实验结论;
(2)实验中剩余气体的性质为难溶于水或不能燃烧或不支持燃烧;
(3)实验后发现测定出空气中氧气的体积分数小于![]() ,则可能的原因有红磷不足,装置漏气,为冷却到室温就打开弹簧夹等;
,则可能的原因有红磷不足,装置漏气,为冷却到室温就打开弹簧夹等;
(4)若将红磷换成木炭,燃烧产物为二氧化碳,反应前后集气瓶中压强几乎不变,故不能成功;
(6)白磷燃烧放热会导致空气膨胀,使水进入导管中,使液面下降,冷却后,集气瓶中压强减小,使水进入集气瓶中,导致液面上升,故瓶内水面的变化是先下降后上升;氧气占空气体积的五分之一,故进入集气瓶中水的体积=(150mL-50mL)×1/5=20 mL,故最终集气瓶中水的体积=20 mL+50mL=70mL;
(7)集气瓶里预先装进的50mL水,在实验过程中起到的作用有:冷却集气瓶,液封导管末端以防气体逸出,缓冲集气瓶内气压的骤然升高。故本题选ABC。


科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,回答下列问题:
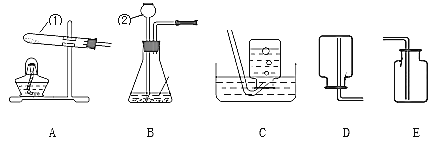
(1)写出图中仪器①②的名称:①_______________ ② _______________ 。
(2)实验室用H2O2溶液制取氧气,可选用_____(填字母,下同)做发生装置,选用________做收集装置,反应的文字表达式是:_____________________________。
(3)如果用高锰酸钾制氧气,该实验的主要操作有:①装药品并在试管口塞一小团棉花 ②收集气体③检查装置的气密性④将导管移出水面⑤固定装置⑥停止加热⑦给试管加热.将上述操作步骤按正确的顺序进行排序_____________________(填序号)。若改用下图的装置进行排空气法收集氧气,则气体应从________(选填“a”或“b”)口进入。
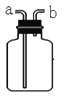
(4)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气是一种无色、有刺激性 气味的气体,密度比空气小,极易溶于水。若制取并收集氨气,应该从图中选择发生装置________ 和收集装置_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列反应的文字表达式并回答相关问题:
(1)高锰酸钾制取氧气_________________________________;
(2)把二氧化碳通入澄清的石灰水________________________________;
(3)含有大量镁粉的照明弹的燃烧________________________________;上述反应中,生成白色固体的有_____________(填序号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定回收废旧手机中含Zn、Fe的电路板中金属的含量,取50g废旧电路板残渣,向其中加入100g7.3%的稀盐酸恰好不再产生气泡,过滤出杂质,将滤液蒸干,得12.1g固体氯化物(不含结晶水),则:废旧电路板残渣中含金属(Zn和Fe之和)的百分含量为( )
A. 5% B. 10% C. 20% D. 30%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在高温的条件下,用CO还原金属氧化物ZnO和Fe2O3的混合粉末。
[提出问题] 在高温的条件下,CO能还原ZnO和Fe2O3混合粉末吗?
[进行假设] 上述猜想正确,请写出其中CO充分还原Fe2O3的化学方程式为①________________;
[设计实验]教材中设计下列实验,填写实验报告:

______________
[提出问题] 实验后的粉末一定是Zn和Fe吗?
[设计实验] 实验后,为证明玻璃管中的粉末是Zn和Fe,请你设计下列两个实验:
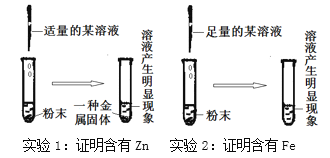
[反思交流]
(1)实验1:反应的化学方程式可能是③______________;
(2)实验2:观察到的现象是:粉末消失,溶液的颜色④___________________;
(3)在上述CO还原ZnO和Fe2O3混合粉末装置中,为节省燃料,请你提出在原装置基础上的一种改进方法是⑤____________________;
[拓展应用] CO能还原某些金属氧化物,在工业上可用于炼铁。在用赤铁矿炼铁时(如图),从高炉里流淌出的高温红热的生铁水没有大量氧化,有多种因素,你所知道的主要原因是:⑥____________________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列每项化学方程式的书写及所属基本反应类型都正确的是( )
选项 | 化学反应方程式 | 反应类型 |
A | Cu+H2SO4=CuSO4+H2↑ | 置换反应 |
B | H2O2 | 分解反应 |
C | 4P+5O2 | 氧化反应 |
D | Na2CO3+CaCl2=CaCO3↓+2NaCl | 复分解反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在工农业生产和日常生活中有着广泛应用。
(1)下列有关酸、碱、盐的说法中正确的是_____。
A.酸有相似的化学性质,因为酸溶液中都含有H+
B.碱中含有氢、氧元素,所以含有氢、氧元素的化合物都是碱
C.中和反应生成盐和水,能生成盐和水的反应一定是中和反应
D.盐是由金属离子和酸根离子组成的,NaCl中没有酸根,所以不属于盐
(2)在铁制品表面镀铬(Cr)可以防止铁生锈,工业上获取镀铬原料三氧化铬的化学反应方程式为:Na2Cr2O7+X=2CrO3+Na2SO4+H2O,其中X的化学式为_____。
(3)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化,得到如图所示曲线。
①用滴管滴加的溶液是_____
②写出C点溶液中所含溶质的化学式_____
③该小组同学在探究过程中发现有气泡产生,请用化学方程式解释产生气泡的原因:_____、_____
④请设计实验验证原氢氧化钠溶液已经部分变质___________。(请写出实验步骤)
(4)岩岩通常是以“卤水”的形式被抽取出来的,某探究小组利用氯化钠和硝酸银反应来测定卤水中的氯化钠含量,取卤水200g,加入200g硝酸银溶液时,恰好完全反应(卤水中其它成份不参予反应),测得反应后溶液质量为256.5g,则该卤水中NaCl质量为多少_______?

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某元素R的结构示意图为:
(1)当x=10+y时,该粒子为_______(填“原子”、“阳粒子”或“阴离子”),当x<10+y时,该粒子为__________。
(2)若R是原子,当y=2时,x=_________。该元素能形成的离子符号为__________。
(3)若该结构示意图表示的粒子是R-,x= ________,y=__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2012年6月24日,中国载人航天工程实现新突破,神舟九号航天员成功驾驶飞船与天宫一号目标飞行器对接,这标志着中国成为世界上第三个完整掌握空间交会对接技术的国家。

(1)为完成此次任务所做的各项准备中,属于化学研究对象的是____________(填字母序号)。
A.飞船内电路系统的设计
B.制作神舟九号太阳能帆板的材料
C.航天员在地面进行1500多次对接操作模拟训练
(2)四氧化二氮(N2O4)是运载神舟九号的长征2号F运载火箭的推进剂之一。在室温、101 kPa时,四氧化二氮是无色气体,易转化为二氧化氮(NO2)。二氧化氮在紫外线的作用下能破坏臭氧层。因此,我国将于2014年投入使用的长征5号运载火箭将全部使用无毒无污染的新型环保燃料。
①从物质分类的角度来看,四氧化二氮属于 (填字母序号)。
A.单质 B.化合物
②在一定条件下,四氧化二氮转化为二氧化氮属于 (填“物理变化”或“化学变化”)。
③液态四氧化二氮的化学性质与气态四氧化二氮相同,请从微观的角度分析其原因_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com