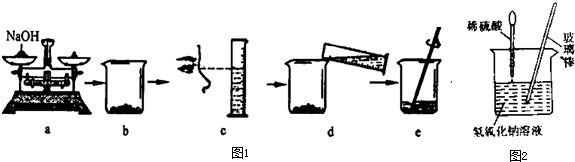
解:(1)氢氧化钠具有强烈的腐蚀性,不能放在纸上称量,应放于玻璃器皿中称量;
(2)导致氢氧化钠溶液溶质的质量分数偏低的因素有溶质偏少、溶剂偏多;
A.a操作中砝码和氢氧化钠放错盘,物码倒置,称量物的质量减小,溶质减少,则溶质的质量分数偏小,正确;
B.b中烧杯用水洗涤后未干燥就使用,造成溶剂的量偏多,则溶质的质量分数偏小,正确;
C.c操作中平视量筒凹液面最低处读数为37.5ml,溶质、溶剂的量正确,溶质的质量分数不变,故错误;
D.d操作中有少量水溅出,不影响溶质的质量分数,故错误;
(3)小华同学用配制的溶液进行中和反应实验,(如图2所示装置),反应后为确定硫酸和氢氧化钠是否刚好完全反应,他取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论.
①硫酸和氢氧化钠反应生成硫酸钠和水,反应的化学方程式是2NaOH+H
2SO
4=Na
2SO
4+2H
2O;
②小亮认为小华的结论不准确,酸碱反应后加入酚酞呈无色,不一定正好完全反应,可能酸过量;
③验证二者恰好完全反应,显中性,可用紫色石蕊试液检验,检验酸是否过量的方法较多,应选择现象明显,操作简便的试剂,可用石蕊试液,滴加碳酸钠,加入锌粒等;
④小华同学在滴入稀硫酸的过程中,观察到有少量气泡出现.产生气泡的原因可能是:部分氢氧化钠与空气中的二氧化碳反应生成碳酸钠,碳酸钠和硫酸反应生成二氧化碳;
(4)氢氧化钠溶液与空气中的二氧化碳反应生成的碳酸钠溶液也显碱性,也能使酚酞变红,所以红色不会消失,故B错误;
开始时,氢氧化钠溶液滴入酚酞试液中溶液变成了红色,所以不是酚酞变质的原因,故A也不正确;
故答案为:(1)称量氢氧化钠时,将氢氧化钠放在纸上称量;
(2)AB;
(3)①2NaOH+H
2SO
4=Na
2SO
4+2H
2O;
②硫酸过量;
③
| 实验 | 实验操作 | 实验现象 | 实验结论 |
| 甲 | 取样,滴加紫色石蕊试液 | 试液不变色 | 两种物质已恰好完全中和 |
| 乙 | 取样,滴加紫色石蕊试液 | 试液变红色 | 第二种可能性 |
④部分氢氧化钠与空气中的二氧化碳反应生成碳酸钠,碳酸钠和硫酸反应生成二氧化碳;
(4)AB.
分析:(1)氢氧化钠具有强烈的腐蚀性,不能放在纸上称量,应放于玻璃器皿中称量;
(2)导致氢氧化钠溶液溶质的质量分数偏低的因素有溶质偏少、溶剂偏多,并结合选项分析解答;
(3)①硫酸和氢氧化钠反应生成硫酸钠和水,据此书写方程式;
②向氢氧化钠溶液中滴加稀硫酸后,加入酚酞溶液不变色,不能说明恰好完全反应,因为当酸过量时酚酞也呈无色;
③探究酸是否过量的方法比较多,可选用指示剂或能与酸反应有明显现象的物质,如碳酸盐,活泼金属等;
(4)可以根据物质性质和实验目的等方面进行分析、判断,从而得出正确的结论.
点评:解答本题时要充分理解各种物质的性质,只有这样才能对问题做出正确的判断,同时要明确酸碱中和的化学方程式,学会检验酸碱的方法,并注意方法的可行性.



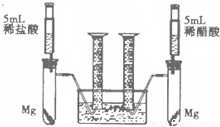
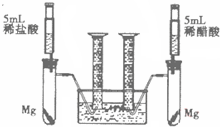 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.

 ),反应的化学方程式为 。
),反应的化学方程式为 。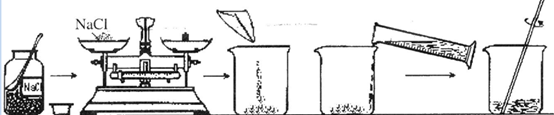 取食盐的过程中,发现指针偏向分度盘右侧,
取食盐的过程中,发现指针偏向分度盘右侧, 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.