
 A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去).
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去).

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| 实验步骤 | 实验现象 | 实验结论 |
①如图装置,把少量样品放入a试管中加热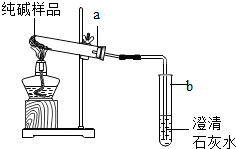 | ②b试管澄清石灰水 没变浑浊 | ③纯碱样品中 |
| ④取样品少量,溶解,加足量稀硝酸,再滴加硝酸银溶液 | ⑤ | ⑥纯碱样品中有NaCl |

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、用燃烧的方法鉴别羊毛和塑料 |
| B、用碘液鉴别淀粉和白糖 |
| C、用肥皂水鉴别硬水和软水 |
| D、用观察颜色的方法鉴别一氧化碳和二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com