



 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:初中化学 来源: 题型:
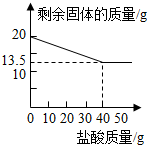 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| 1 | 10 | 18.375 |
| 2 | 10 | 16.750 |
| 3 | 10 | 15.125 |
| 4 | 10 | 13.500 |
| 5 | 10 | 13.500 |
查看答案和解析>>
科目:初中化学 来源: 题型:
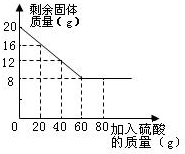 某化学兴趣小组的同学为测定Cu和CuO混合样品中CuO的含量,甲、乙、丙、丁四位同学均先称取20g样品于烧杯中,在分别加入20g、40g、60g、80g溶质质量分数相同的稀硫酸.充分反应后,均有固体剩余.经过滤、干燥后称量,剩余固体质量如下图所示.回答下列问题:
某化学兴趣小组的同学为测定Cu和CuO混合样品中CuO的含量,甲、乙、丙、丁四位同学均先称取20g样品于烧杯中,在分别加入20g、40g、60g、80g溶质质量分数相同的稀硫酸.充分反应后,均有固体剩余.经过滤、干燥后称量,剩余固体质量如下图所示.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com