
【题目】如图是取大小形状相同的Mg、Zn、Fe、Cu四种金属与相同浓度的稀盐酸反应状况的示意图.仔细观察并结合所学的知识回答下列问题:

(1)不能与稀盐酸反应的金属是__________.
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是___________,其中反应速率最快的是__________,请写出它与盐酸反应的化学方程式是_____________.
(3)通过以上实验(或图示)说明,Zn和Cu的金属活动性强弱是___________.
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%______反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | _____产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率____ |
(5)通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种____________.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越_____________(填“快”或“慢”).
【答案】铜 有气泡产生 镁 Mg+2HCl=MgCl2+H2↑ 锌大于铜 盐酸 铁粉 快 金属的性质或种类、酸溶液的浓度、金属与酸溶液的接触面积等 快
【解析】
(1)由四种金属与盐酸反应状况的示意图可知,没有气泡生成的金属是铜,说明了不能与盐酸反应的金属是Cu;
(2)由四种金属与盐酸反应状况的示意图可知,有三种金属能与盐酸反应,其共同的反应现象是产生气泡;由四种金属与盐酸反应状况的示意图可知,产生气泡最快的就是反应速率最快的,是镁;镁与稀盐酸反应生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl=MgCl2+H2↑;
(3)由四种金属与盐酸反应状况的示意图可知,铜不能与酸反应金属活动性最弱,镁与酸反应产生的气泡最多,镁最活泼,其次是锌,产生的气泡最慢的是铁,所以,四种金属的金属活动性由强到弱的顺序为Mg>Zn>Fe>Cu.
(4)①探究哪些因素可以影响金属与酸溶液反应的速率,所以实验中用的酸种类要相同,故填盐酸。②药品的接触面积越大反应速率越大,故铁粉快。③反应物的浓度越大,反应的速率越大,故填快;温度越高,反应速率越快.
故答案为:(1)铜;(2)有气泡产生;镁;Mg+2HCl=MgCl2+H2↑;
(3)锌大于铜;(4)盐酸;铁粉;快;(5)金属的性质或种类、酸溶液的浓度、金属与酸溶液的接触面积等;快.


科目:初中化学 来源: 题型:
【题目】A、B是生活中常见的两种液态物,元素种类相差一种其中B可作燃料也可作汽车燃料添加剂;C和D为一种常见的黑色固体,其中C其相对分子质量为80。图中的“→”表示物质间转化,“一”表示相互之间能反应。
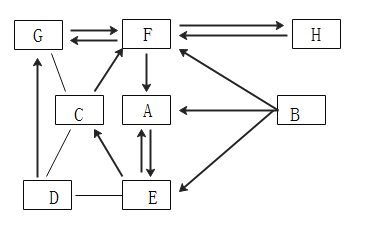
(1)B的化学式为_____。写出F转化成A的化学反应方程式_____,写出基本反应类型中G变成F的化学反应方程式:_____。
(2)以下说法正确的是(____)
①B转化成A的过程放出大量热,是化合反应
②H可以通过分解反应转化成F
③图中 ABCFGH均属于氧化物
④工业制取E的方法是物理变化,F可用于人工降雨
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是初中化学常见的物质,其中丁是大理石的主要成分,乙的固体俗称干冰,它们之间的部分转化关系如图所示。(“→”表示某物质经一步反应可转化成另一种物质,“一”表示相连的两物质之间能发生化学反应,反应条件及部分反应物或反应条件及部分反应物或生成物已经省略)。
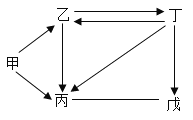
(1)乙的化学式为_____。
(2)丁→丙反应的化学方程式为_____。
(3)丙和戊反应的现象是_____。
(4)关于甲以及甲→丙的反应,有如下说法,其中正确的是_____
A 甲可能是金属
B 甲可能具有可燃性
C 甲→丙的反应可能属于分解反应
D 甲→丙的反应可能属于化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合有关实验,回答下列问题:
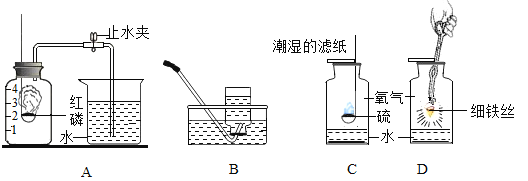
(1)用A实验验证空气中氧气的含量,能得到的正确结论是_____
(2)用B装置收集氧气时,得到的气体不纯,造成这种后果的原因可能是_____
(3)C实验中潮湿的滤纸和水的作用是_____
(4)图D是电解水的实验装置。实验中.试管甲中产生的气体是_____(填名称)它连接的是电源的_____极,当水分子分解时,生成氢原子和_____, 每两个氢原子结合成一个_____下列还能确认水是由氧元素和氢元素组成的实验是_____(填序号)。
A 氢气在氯气中燃烧
B 水的蒸发
C 氢气在氧气中燃烧
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学以实验为基础,水在化学实验中的作用不可忽视。下图中五个实验都用到水。
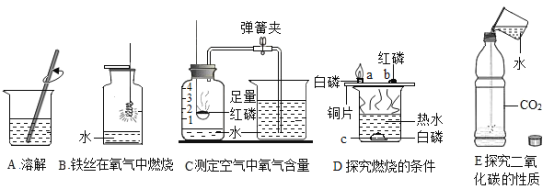
(1)实验 B 中水的作用是_____。
(2)实验 C 中红磷燃烧反应的化学方程式是_____;通过烧杯中的水进入集气瓶中的体积可得出氧气约占空气总体积 _____的结论。
(3)实验 D 中水的作用是提供热量和_____。
(4)实验 E 中的水发生的反应的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“中国制造”“一带一路”等基础建设都需要用到大量钢铁。
(1)认识铁及其应用
①从微观看,铁是由_____(填化学符号)构成,其在地壳中的含量居所有金属元素第_____位。
②生铁和钢均是生活中常见的铁材料,它们都属于_____(填“纯净物”或“混合物”)。
③生铁可用以铸成铁锅,利用了金属铁的_____性。很多人认为:铁锅炒菜过程中摩擦产生的“铁屑”进入人体后,会与胃液中的盐酸反应,请写出铁与稀盐酸反应的化学方程式_____,该反应的基本反应类型为_____,所以用铁锅炒菜“补铁”,这里的“铁”指_____(填“原子”“单质”或“元素”),实质生成的铁为非血红素铁,人体吸收效果甚微。
(2)铁的冶炼:下图为某钢铁公司的矿石选取、冶铁和炼钢的工艺流程。
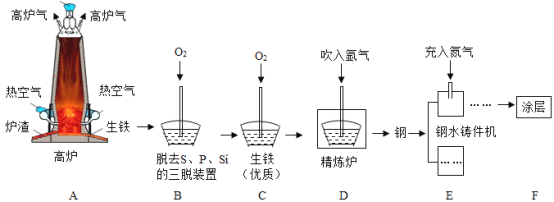
①用赤铁矿石冶铁的反应原理是_____(用化学方程式表示)。
②分析工艺流程,三脱装置中发生反应的化学方程式是_____(任写一个)。
③向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,该过程类似于化学实验中的_____操作。
④在钢水铸件机中,高温钢加工成钢制零件时,充入氮气的作用是_____。
(3)铁的防护
①铁制品长期暴露于潮湿的空气中,其表面易形成_____色的铁锈,由于铁绣制品的结构特点是_____,故铁制品表面的铁锈应及时清除。
②请列举一种常见的清除铁锈的方法_____。
③家庭使用的铁锅如何防锈?_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,回答有关问题。

(1)装置图中仪器a的名称为___。
(2)用氯酸钾和二氧化锰混合制取氧气,可选用的发生装置是___(填字母),写出该反应的化学方程式___;若用D装置收集氧气,当导管口气泡___冒出时,再把导管口伸入盛满水的集气瓶。
(3)实验室用B装置制取二氧化碳的化学方程式为___,如果用G装置收集气体,气体应从___(填“b”或“c”)端通入;用C装置代替B装置,收集所需的气体量后,对C装置进行的操作是___。
(4)水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。
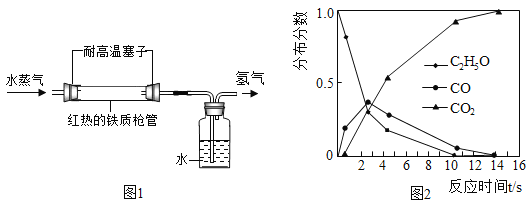
①1766年,英国化学家卡文迪许用锌和稀硫酸制得“可燃空气”,他所说的“可燃空气”成分是___(填化学式)。“可燃空气”在纯氧中燃烧生成水,可得出“水是一个结合物而不是简单元素”。
②1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁,实验示意图如图1所示。上述反应的化学方程式为___。该反应若生成1g氢气,则理论上铁制枪管应增重___g。
③当温度、压强分别超过临界温度(374.2℃)和临界压强(22.1MPa)时的水称为超临界水。现代研究表明:超临界水能够与氧气以任意比例互溶,由此发展了超临界水氧化技术。550℃时,测得乙醇(C2H6O)的超临界水氧化结果如图2所示。图中CO的分布分数先增后降的原因是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用生活中的废弃材料来做家庭小实验,其乐无穷!小美同学设计了如图所示的装置(a、d为浸有紫色石蕊试液的湿润棉花,b、c为用紫色石蕊试液浸过的干燥棉花。垂直固定装璃管的装置末画出)来探究二氧化碳的制取和性质。下列关于该实验装置的叙述不正确的是( )
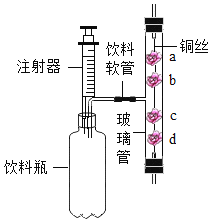
A. 通过推压性注射器活塞,可以控制进入饮料瓶内液体的量
B. 利用该装置制取二氧化碳时注射器内的液体可为稀硫酸
C. 利用该装置可验证二氧化碳的密度比空气大及二氧化碳能与水发生反应
D. 该装置的左半部也可用于制取氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com