(2012?高淳县二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO
2)固体,为鱼提供氧气.
过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?【猜想】另一生成物为氢氧化钙.
【进行试验】取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
红
红
色,则猜想成立.
写出该反应的化学方程式
2CaO2+2H2O=2Ca(OH)2+O2↑
2CaO2+2H2O=2Ca(OH)2+O2↑
.
【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,你认为褪色的可能原因是
Ca(OH)2被空气中的二氧化碳反应掉了
Ca(OH)2被空气中的二氧化碳反应掉了
.
【查阅资料】过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质.
实验探究二:测定久置过氧化钙纯
【实验过程】
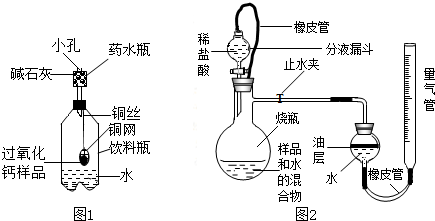
称量144g样品放在铜网中,按图1装置组装后 (药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器及反应后物质总质量.测得实验数据如下表.
|
样品
质量 |
装置及药品
总质量 |
装置及反应后物质
总质量 |
| 实验数据 |
144g |
394g |
378g |
【问题讨论】
(1)药水瓶中碱石灰的作用为
吸收O2中的水蒸气
吸收O2中的水蒸气
.
(2)本实验测得过氧化钙含量可能会偏小的原因是
生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
.
(3)根据实验数据计算:
①生成氧气
16
16
g.
②样品中过氧化钙的含量是
72
72
g.
实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性合格;
②称量20g样品置于烧杯中,加入适量水混合,完全反应后全部倒入下图的烧瓶中,向分液漏斗中加入足量稀盐酸待用;
③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管内液面与油层液面相平,读出气体体积;
⑤查得CO
2的密度,计算样品中碳酸钙的质量分数.
上下移动量气管,至量气管内的液面与油层液面相平
上下移动量气管,至量气管内的液面与油层液面相平
(4)图中油层的作用为
隔绝水和CO2,防止CO2溶于水
隔绝水和CO2,防止CO2溶于水
,油层上方留有空气,会使测量结果
不受影响
不受影响
(填“偏大”、“偏小”或“不受影响”).中和反应明显放出热量,滴加稀盐酸后,发生装置里发生的中和反应的化学方程式为
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
,这个反应的发生可能使测定结果
偏大
偏大
(填“偏大”、“偏小”或“不受影响”).
(5)反应结束后,测得量气管读数为1120ml,根据该条件下CO
2的密度得知生成CO
2的质量为2.2g.求样品中碳酸钙的质量分数(写出计算过程).
设碳酸钙的质量分数为y
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
20g?y 2.2g
= y=25%
设碳酸钙的质量分数为y
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
20g?y 2.2g
= y=25%
(6)步骤④中再次调节量气管内液面与油层液面相平的方法
上下移动量气管,至量气管内的液面与油层液面相平
上下移动量气管,至量气管内的液面与油层液面相平
.步骤②中将样品和水混合的目的是
除去CaO2,防止在烧瓶中产生氧气
除去CaO2,防止在烧瓶中产生氧气
.
(7)充分反应后将烧瓶中的液体蒸干,得到27.75g固体,这袋样品在变质前全为过氧化钙,其质量为
18
18
g.




 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案