将一包碳酸钾和硫酸钾的混合物溶于蒸馏水配成溶液,加入适量的氢氧化钡溶液完全反应,滤出并洗涤沉淀,然后在沉淀中加入稀硝酸,收集到4.4克无色气体.再在滤液中滴入几滴酚酞试剂,并逐渐加入20%的盐酸到溶液刚变为无色为止,用去了45.625克盐酸.
求:(1)能生成溶于酸的沉淀物多少克?
(2)原混合物中硫酸钾有多少克?
解:(1)设能生成溶于酸的沉淀物的质量为x,
BaCO
3+2HNO
3═Ba(NO
3)
2+CO
2↑+H
2O
197 44
x 4.4g
∴
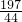
=
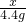
,
解之得:x=19.7g;
(2)①设与45.625克盐酸恰好反应的KOH的质量为y,
用去45.625克盐酸中HCl的质量为:45.625×20%=9.125g,
KOH+HCl=KCl+H
2O
56 36.5
y 9.125g
∴

,
解之得:y=14g;
②设K
2CO
3与Ba(OH)
2反应生成氢氧化钾的质量为z,
K
2CO
3+Ba(OH)
2=2KOH+BaCO
3↓
112 197
z 19.7g
∴

,
解之得:z=11.2g;
③设原混合物中硫酸钾的质量为m,
K
2SO
4与Ba(OH)
2反应生成氢氧化钾的质量为:14g-11.2g=2.8g,
K
2SO
4+Ba(OH)
2═2KOH+BaSO
4↓
174 112
m 2.8g
∴
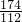
=
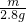
,
解之得;m=4.35g.
答:(1)能生成溶于酸的沉淀物19.7g;(2)原混合物中硫酸钾的质量为4.35g.
分析:此题属于多步反应的计算题,应先找出关系式,然后根据关系式解题.本题涉及的反应有①K
2CO
3+Ba(OH)
2=2KOH+BaCO
3↓,②K
2SO
4+Ba(OH)
2═2KOH+BaSO
4↓,③BaCO
3+2HNO
3═Ba(NO
3)
2+CO
2↑+H
2O,④KOH+HCl=KCl+H
2O;
(1)由题意可知,溶于硝酸的沉淀为①反应中的沉淀BaCO
3,所以利用化学方程式③和生成气体的质量,列出比例式,就可计算出能生成溶于酸的沉淀物的质量;
(2)①根据化学方程式④和要中和反应中生成的氢氧化钾的质量用去盐酸的质量,列出比例式,就可计算出碳酸钾和硫酸钾与氢氧化钡反应生成的氢氧化钾的质量;
②利用化学方程式①和计算出的沉淀的质量,列出比例式,就可计算出反应①中生成氢氧化钾的质量;
③利用化学方程式②和生成的氢氧化钾的质量,列出比例式,就可计算出原混合物中硫酸钾的质量.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

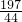 =
=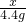 ,
, ,
, ,
,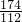 =
=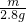 ,
,

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案