

分析 Ⅰ.(1)碳酸氢铵和氯化钠反应能生成氯化铵和碳酸氢钠,碳酸氢钠受热分解能生成碳酸钠、水和二氧化碳;
(2)铵盐和显碱性的物质反应能生成氨气,氯化铵和硝酸银反应能生成氯化银沉淀.
Ⅱ.(1)碱石灰能够吸收二氧化碳和水,氢氧化钠溶液能够吸收空气中的二氧化碳;
(2)浓硫酸能够吸收水;
(3)碱石灰能够吸收空气中的水蒸气和二氧化碳;
(4)根据化学方程式可以进行相关方面的计算.
解答 解:Ⅰ.(1)碳酸氢铵和氯化钠反应的化学方程式为:NH4HCO3+NaCl═NH4Cl+NaHCO3↓.
碳酸氢钠受热分解的化学方程式为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故填:NH4HCO3+NaCl═NH4Cl+NaHCO3↓;2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)氯化铵能和碱反应生成氨气,氨气的化学式是NH3.
故填:NH3.
氯化铵能和硝酸银反应生成白色沉淀氯化银,硝酸铵不能和硝酸银反应,可以用硝酸银溶液区别氯化铵和硝酸铵,硝酸银的化学式是AgNO3.
故填:AgNO3.
Ⅱ.(1)鼓入空气的目的是驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.装置A能够除去空气中的二氧化碳,氢氧化钠溶液能够吸收二氧化碳.
故填:驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收;氢氧化钠溶液.
(2)若没有C装置,二氧化碳中的水蒸气也能够被碱石灰吸收,则会导致测定结果偏大.
故填:偏大.
(3)E装置的作用是防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.
故填:防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.
(4)解:反应生成二氧化碳的质量为:85.6g-83.4g=2.2g,
设纯碱样品中Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 2.2g
106:44=x:2.2g
x=5.3g
纯碱样品中碳酸钠的质量分数为:$\frac{5.3g}{6.0g}$×100%=88.3%.
答:纯碱样品中碳酸钠的质量分数为88.3%.
点评 本题主要考查物质的性质、用途及其化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
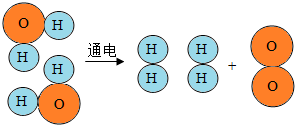 如图是水分子在通电条件下分解的示意图.从图中你可以获得哪些信息,请任写三条:
如图是水分子在通电条件下分解的示意图.从图中你可以获得哪些信息,请任写三条:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化物中一定含有氧元素,则含氧元素的化合物一定是氧化物 | |
| B. | 分子发生改变的变化一定是化学变化,则化学变化中分子一定发生改变 | |
| C. | 单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 | |
| D. | 离子是带电荷的微粒,则带电荷的微粒一定是离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
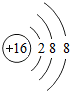 表示的粒子S2-.
表示的粒子S2-.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
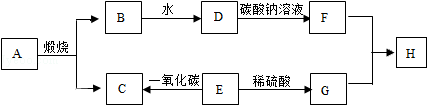
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 墙内开花墙外可嗅到花香,说明分子在不停地运动 | |
| B. | 湿衣服在阳光下比在阴凉处易于晾干,说明分子运动速率随温度升高而加快 | |
| C. | 水由液态变成气态,体积膨胀,说明水分子体积变大 | |
| D. | 将l00mL水与l00mL酒精混合,体积小于200mL,说明分子间有间隔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com