解:(1)固体D的质量是Fe和CuCl
2溶液反应生成的Cu和CO还原氧化铜生成的Cu的总质量,即两份X样品中铜元素的总质量,所以,每份样品中铜元素的质量为8g.每份样品中氧化铜的质量为:8g÷64×80=10g,设与盐酸反应的铁的质量为x
Fe+2HCl═FeCl
2+H
2↑
56 2
x 0.5g
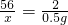
x=14g
设与CuCl
2反应的铁的质量为y
Fe+CuCl
2=FeCl
2+Cu
56 64
y 8g

y=7g
每份X样品中铁元素的质量为:14g+7g=21g
每份X样品中氧化亚铁的质量为:
21g÷
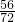
=27g
因此,每份X样品中氧化亚铁和氧化铜的质量比为:27g:10g=27:10
(2)氧化亚铁和氧化铜的“分子”个数比为:

:

=3:1,每份X中铁原子和氧原子的个数比为:3:(3+1)=3:4
答:每份X中氧化亚铁与氧化铜的质量比为27:10,每份X中铁与氧的原子个数比为3:4.
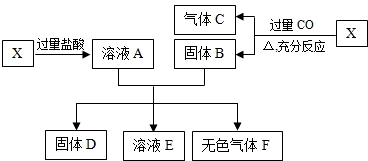
分析:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据叙述的关键,以及物质的性质和物质之间的反应,做出判断,X为氧化亚铁与氧化铜的混合物,与过量的盐酸反应形成的溶液A含有盐酸,与过量一氧化碳反应生成的固体B含有铁和铜,固体A和B反应的到了固体D和溶液E,则D中含有铜,溶液E含有氯化亚铁,所得固体D的质量为16g,溶液E中含有盐酸和一种盐,则铁全部参加反应,D为铜,E中含有氯化亚铁和盐酸,根据题干提供的据以及反应的化学方程式进行计算即可.
点评:本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质的化学式,然后顺推或逆推或由两边向中间推得出其他物质的化学式,根据方程式进行计算时,要找准参加反应的物质的质量.

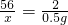

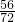 =27g
=27g :
: =3:1,每份X中铁原子和氧原子的个数比为:3:(3+1)=3:4
=3:1,每份X中铁原子和氧原子的个数比为:3:(3+1)=3:4




