
����Ŀ��NH4Cl��Na2SO4���ܽ�ȱ����ܽ���������¡�����˵����ȷ����
�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ�� S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
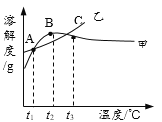
A. ��ΪNH4Cl
B. t3��Ӧ����30����40��
C. �����ʵı�����Һ��t2���µ�t3����Һ������������������
D. �ס��ұ�����Һ��t3���µ�t1���������壨�������ᾧˮ��������һ�����
���𰸡�C
��������
A��ͨ�������ܽ�ȱ��е����ݿ�֪���Ȼ�淋��ܽ�����¶ȵ����߶�����������Ϊ�Ȼ�泥���ѡ�����
B������NH4Cl��Na2SO4���ܽ�ȱ����ס����ܽ�ȵڶ������ʱ��Ӧ���¶���40��-50�棬�����ܽ�����ߣ��ס����ܽ�ȵڶ������ʱ��Ӧ���¶�С��t3�棬��t3Ӧ����40�棬��ѡ�����
C�������ʵı�����Һ��t2���µ�t3���ܽ���������������壬��Һ�����������������䣬��ѡ����ȷ��
D����Ϊû��ָ����Һ���������ס��ұ�����Һ��t3���µ�t1�����ľ���������һ����ȣ���ѡ�����ѡC��


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������ܺ���Na2CO3��Na2SO4��CuSO4��CaCl2��NaCl�е�һ�ֻ��֣�Ϊ��ȷ���û����ijɷ֣���������ʵ�飺
����I:��������������ˮ����������ɫ����Һ
����II:������Һ�еμ��������ᱵ��Һ���а�ɫ��������
����III:���ˣ�������������ϡ�����У����ֳ���ȫ���ܽ⣬���ų����塣���жϣ�
(1)���������п϶���_____���϶�û��_____��������_____
(2)�Կ����е����ʣ��ɲ�������III�е���Һ�μ�_____��Һ�����顣
(3)д������III�з����Ļ�ѧ����ʽ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHCO3��270��ʱ��ȫ�ֽ�Ϊ̼���ơ�ˮ�Ͷ�����̼����Na2CO3���Ȳ��ֽ⣮����ij������������һ��NaHCO3��Ʒ�л���������Na2CO3��ij��ȤС��ͬѧΪ�˲ⶨ�ò�Ʒ��NaHCO3�������������������������ʵ�鷽����
����һ����Ʒ![]() �ⶨ����CO2��������
�ⶨ����CO2��������

��1����ʵ�������ͼ��ʾ��װ�ã�C��ʢ�ŵ������� ��
��2�����ѷ�Һ©���е�ϡ�����Ϊϡ���ᣬ������������ȷ������£� ����ܡ����ܡ���ȷ�ⶨ��Ʒ��NaHCO3������������
����������Ʒ![]() �ⶨʣ�����������
�ⶨʣ�����������
��������������£�
��һֻ�ྻ���������Ƶ�����Ϊ21.2�ˣ��������м�����Ʒ���Ƶ�������Ϊ41.2�ˣ�
�ڼ���ʢ����Ʒ��������
�۽����������ȴ������������ʣ������������
�ܶ���ظ�����ں͢������أ��Ƶ�������ʣ������������Ϊ35.0�ˣ�
��3��ʵ��ʱ��Ҫ�ظ������ȡ���ȴ��������������Σ���Ŀ���� ��
��4���������⣬������Ʒ��NaHCO3������������д��������̣�
����֪2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽������������Һ�ķ�Ӧ���ɣ���һ��������п�ۺ����ۼ��뵽����ͭ��Һ�У���ַ�Ӧ��ʵ����̼�ʵ����������ͼ��ʾ��������˵������ȷ����
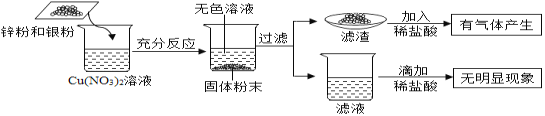
A. �����п��ܺ�����пB. ������һ������Cu��Ag��Zn
C. ��Һ��һ������Zn2+��Ag+D. ��ַ�Ӧ����Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�ᱵ�㷺Ӧ��������ܡ��մɡ���ѧ��������ҵ����һ��̼���ο�ʯ����Ҫ�ɷ�Ϊ̼�ᱵ��̼��ƣ��Դ˿�ʯΪԭ������̼�ᱵ��������ͼ��ʾ��
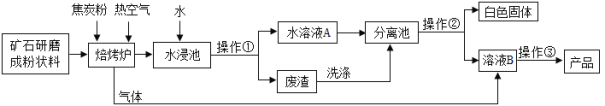
���������ϣ�
I��̼�ᱵ��̼��ƾ������ƵĻ�ѧ���ʣ��������������ƶ�����ˮ��Ӧ���ɶ�Ӧ�ļ������������������̼��Ӧ��
���±���ʾ�������ּ��ڲ�ͬ�¶��µ��ܽ��
�¶�/�� | 0 | 40 | 80 |
Ca(OH)2�ܽ�ȣ�g | 0.187 | 0.141 | 0.094 |
Ba(OH)2�ܽ�ȣ�g | 1.67 | 8.22 | 101.4 |
��1��д��ˮ��������������ˮ��Ӧ�Ļ�ѧ����ʽ____________��
��2���������˵����ȷ����________��
a����¯�����ӽ�̿�ۺ��ȿ�����Ϊ��ά��¯�ڷ�Ӧ����ĸ���״̬��
b����¯��ֻ�漰�ֽⷴӦ��
c������Ҫ����ϴ�Ӳ�����������Ϊ�˱���������ͬʱΪ����߲��ʣ�
d�ù������̿��Լ���CO2������ŷţ���������ЧӦ��
��3������ˮ֮�⣬���������е�������_________�������ڵIJ�����________��ѡ�� �������������������������ˡ�
��4��д������ҺB��ȡ��Ʒ̼�ᱵ�Ļ�ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء���ĩС�������Ѵ��ű��ɺ�ˮ�ﳵȥ�������ȼ١�
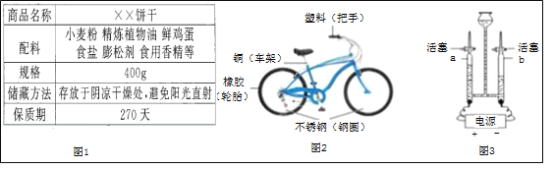
��1��ͼ1Ϊij���ɰ�װ���IJ���˵������ش��������⣺
���ڱ��ɵ������У�������֬����_____��
���������и��������ʵ�������_____��
��С����и������࣬�����������ھ���һϵ�еı仯����ת��Ϊˮ��_____���ѧʽ����
����Ӫ������ĽǶȿ�����ʳƷ�г�ˮ�⣬��ȱ�ٵ�Ӫ������_____��
��2��������ͼ2��ʾ
����ͼ��ʾ���г��е���̥����_____���ϣ�
����ֹ��������������ɲ�ȡ�Ĵ�ʩ��_____��
��д����ϡ�����ȥ����Ļ�ѧ����ʽ_____��
��3���ش���ˮ�йص�����
������ij����ˮ����Ӳˮ������ˮ�����õ��Լ���_____��
��ͼ3װ�õ��ˮʱ��a����b�ܲ���������������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�Ľ��ۻ�����в���ȷ���ǣ�������
A. ˮ�տ����װѺ��dz��𩁩�˵���¶����߷��ӻ���
B. ���Ĺ���ʱ��Ʈ�㩁��˵�������ڲ����˶�
C. ����кͷ�Ӧ��������ˮ����ʵ����H+��OH�� ���������H2O
D. Ũ�����ڿ��������ɰ�������Ũ������лӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����ɫ��ĩ��������NH4Cl��Na2CO3��NaHCO3�е�һ�ֻ�����ɡ�СӨΪ��̽����ɷ֣�����������ʵ�飺
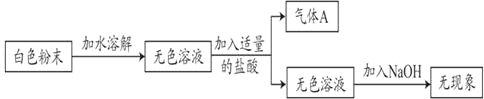
��1��������ʵ���֪����A��_____��
��2������������ʵ������ԭ��ɫ��ĩһ��û��_____��
��3�����������⣩Na2CO3��NaHCO3�����ᷴӦ�����ܲ������壬��ȷ������ijɷ֡�
���������ϣ�
��NaHCO3������Եĸ��Ρ����λ��û�г���������
��NaHCO3��������Ca��OH��2��Ӧ�а�ɫ����������
��������룩
����1����ɫ��ĩֻ��_____��
����2����ɫ��ĩֻ��Na2CO3��
����3����ɫ��ĩ��_____��
��ʵ��̽����
С��Ϊ����֤����룬ȡ�����İ�ɫ��ĩ�����ձ��У���ˮȫ���ܽ����������Ca��OH��2��Һ��������_____��������Ϊ�������ȷ��С����ΪС�µĽ��۲���ȷ��������_____��
���������˽�һ����̽����
ʵ����� | ���� | ʵ����� |
ȡ��ɫ��ĩ���ձ��У���ˮ�ܽ⣬�ټ���BaCl2��Һ��ֽ��裬���� | ����_____���� | ����_____���� |
��_____ | ֤����ɫ����϶���_____��������_____ | |
ȡ10.6g��ɫ��ĩ����ƿ�У���������ϡ���������ɵ�����ͨ��������NaOH��Һ�У���Ӧ��ȫ��Ƶ�NaOH��Һ����4.5g | ȷ�ϲ���_____���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����г��õĻ�ѧ�Լ��������Ƕ���������ʡ���ȡ����;�ȷ����̽�������㹲ͬ���벢�ش��й����⡣
��̽��һ�����������
(1)̽��Ũ�����ijЩ���ԡ�
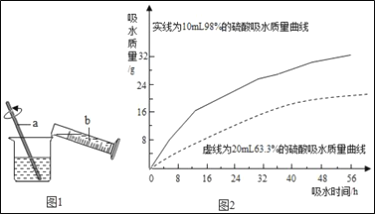
����Сľ��պȡ����Ũ���ᣬ����һ��ɹ۲쵽___��
��Ũ�����ϡ�ͣ�Ũ����ϡ������ͼ1��ʾ��b��ʢ�ŵ�������___��a��������___��
����ȤС���98%��Ũ����10ml��63.3%��������ҺԼ20mL�ֱ����������ͬ��С�ձ��У��������۲졢��¼���������������»�����ʵ������ݻ�ɵ�������ͼ2����ͼ2�������ܵõ���ʵ����ۣ�_____(д����)��
(2)̽��ϡ����Ļ�ѧ���ʡ�
��ͼ3��������ϡ����ֱ����A��E����ֻ�ձ��С�
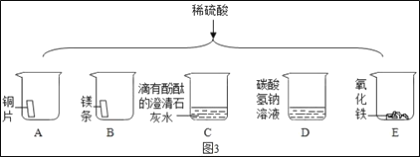
���в������ݵ���___(����ţ���ͬ)���а�ɫ�������ɵ���___��
����֤��C�з�����ѧ��Ӧ��������___��
(3)��д��ϡ�����һ����;___��
��̽����������Ĺ�ҵ�Ʒ���
��ҵ���Ի�����Ϊԭ����������Ĺ���������ͼ4��ʾ��
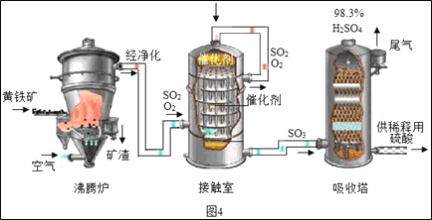
(1)�Ӵ����з����Ļ�ѧ����ʽΪ___��
(2)������������Ĺ�������ͼ������˵����ȷ����___(����ĸ���)��
A Ϊʹ��������ȼ�գ��轫����� B �����ܹ����SO2�ķ�Ӧ���ʺͲ���
C �������еõ��IJ�ƷΪ����� D ����¯�ų��Ŀ����ɹ�����
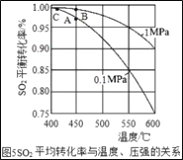
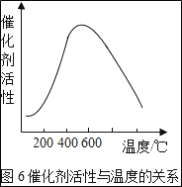
(3)�Ӵ����е�SO2ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ5��ʾ�������������¶ȵĹ�ϵ��ͼ6����ʵ�������У�SO2��������Ӧ������ѡ��ѹ��450��(��Ӧͼ��A��)����û��ѡ��SO2ת���ʸ��ߵ�B��C���Ӧ�ķ�Ӧ��������ԭ��ֱ���___��___��
��̽������̽��ij��������FeS2�ĺ�����
ͬѧ�ǽ���������ʵ��̽����
���������ϣ���4FeS2 +11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��Na2SO3 +H2O2 ��Na2SO4 +H2O
��ʵ��̽����
���ȡ1.60g��������Ʒ������ͼ7��ʾװ��(�г�װ��ʡ��)��ʯӢ���У���a�����ϵػ���ͨ���������������ʯӢ���еĻ�������Ʒ����ȫ��Ӧ��
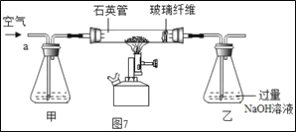
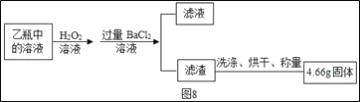
��Ӧ��������ƿ�е���Һ������ͼ8����
���������ۣ�
(1)I��װ�ü�ƿ��ʢ�ŵ��Լ�������������Һ����������___��II����Һ����������һ����___��
�������ⶨ��
(2)II�����յõ���4.66g������___(�ѧʽ)��
(3)����û�������FeS2����������Ϊ___��(д���������)
��������˼��
(4)���ȱ�ټ�װ�ã������ղ��FeS2��������������___(����ƫ������ƫС����������)
(5)���֤��II������BaCl2��Һ�ѹ���(���Ҫд����������������)___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com