
 如图为某钙片的商品标签,根据标签的有关信息,某儿童按标签用量服药,每天补充钙元素质量是0.6g.
如图为某钙片的商品标签,根据标签的有关信息,某儿童按标签用量服药,每天补充钙元素质量是0.6g. 科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
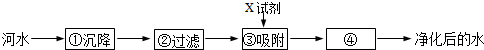
科目:初中化学 来源: 题型:实验探究题
| 发生装置 | 收集装置 | 洗气装置 |
 |  | 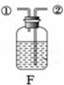 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
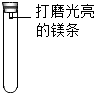 镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.
镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.| 编号 | 主要实验操作 | 实验现象 |
| 1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
| 2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
| 3 | 先加入2mL浓硫酸再通入约4mLCO2 | 镁条始终无明显变化 |
| 4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
| 5 | 先加入2mL蒸馏水再通入约4mLCO2 | 镁条第3天开始变黑至第20天全部变黑 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
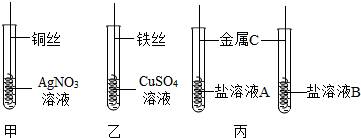
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中逐滴加入氢氧化钠溶液,先产生白色沉淀,后来白色沉淀又消失 | |
| B. | 在NaAlO2中铝元素的化合价为+3价 | |
| C. | 向稀盐酸中加入氢氧化铝,发生中和反应 | |
| D. | 氢氧化铝属于氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
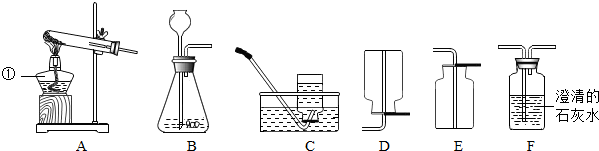
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com