
| A. | 高温条件下木炭还原氧化铜:黑色固体逐渐变成光亮的铜 | |
| B. | 铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| C. | 硫在空气中燃烧发出明亮的蓝色火焰,生成有刺激性气味的气体 | |
| D. | 铜片放入硝酸银溶液中:固体表面有银白色固体产生,溶液由蓝色逐渐变为无色 |
分析 A、根据碳具有还原性进行分析判断.
B、根据铁丝在氧气中燃烧的现象进行分析判断.
C、根据硫在空气中燃烧的现象进行分析判断.
D、根据金属的化学性质进行分析判断.
解答 解:
A、碳具有还原性,能与氧化铜反应,高温条件下木炭还原氧化铜:黑色固体逐渐变成光亮的铜,是实验结论而不是实验现象,故选项说法错误.
B、铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体,故选项说法正确.
C、硫在空气中燃烧发出微弱的淡蓝色火焰,生成有刺激性气味的气体,故选项说法错误.
D、铜片放入硝酸银溶液中,铜与硝酸银溶液发生置换反应生成硝酸铜溶液和银,紫红色固体表面有银白色固体产生,溶液由无色逐渐变为蓝色,故选项说法错误.
故选:B.
点评 本题难度不大,掌握碳的化学性质、常见物质燃烧的现象、电解水的实验现象、金属的化学性质即可正确解答;在描述实验现象时,需要注意实验结论和实验现象的区别.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
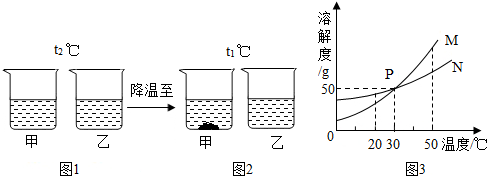
| A. | 图3中M表示的是乙的溶解度曲线 | |
| B. | 图2中甲溶液一定饱和,乙溶液不一定饱和 | |
| C. | 图2乙溶液一定比甲溶液浓 | |
| D. | 当W=50g时,甲、乙溶液溶质质量分数一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 甲中混有少量乙时,可用降温结晶法提纯甲 | |
| B. | t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,甲析出的晶体最多,丙无晶体析出 | |
| C. | t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,溶液中溶质的质量分数为乙>甲>丙 | |
| D. | t2℃时,100g甲物质溶于100g水中,所得溶液的质量为200g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ,请回答下列问题:
,请回答下列问题:
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用霉变的花生榨取食用油 | |
| B. | 室内有煤气泄露,立即打开排气扇通风 | |
| C. | 铵态氮肥可与碱性物质混用 | |
| D. | 久未开启的地窖、窖井,不可冒然进入 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
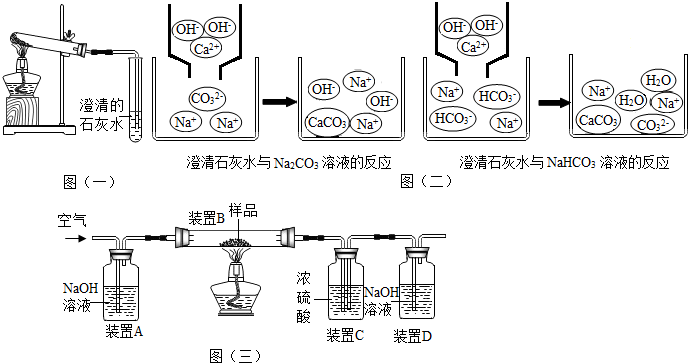
| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com