
分析 纯碱与稀盐酸反应生成氯化钠、水和二氧化碳,由题意,56g工业纯碱是纯碱与氯化钠的混合物;由生成二氧化碳气体的质量,由反应的化学方程式列式计算出参加反应的碳酸钠的质量,进而计算出工业纯碱中碳酸钠的质量分数即可.
解答 解:设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 22g
$\frac{106}{44}=\frac{x}{22g}$ x=53g
工业纯碱中碳酸钠的质量分数为$\frac{53g}{56g}×$100%≈94.6%.
答:工业纯碱中碳酸钠的质量分数为94.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.


科目:初中化学 来源: 题型:填空题
| 验证猜想 | 可行的实验方案 | 观察到的实验现象 |
猜想① | 将一小块果肉浸入盛有煮沸的蒸馏水的烧杯中 | 果肉表面不变色 |
猜想② | 果肉表面变色 | |
猜想③ | 果肉表面不变色 | |
猜想④ | 温度高的先变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
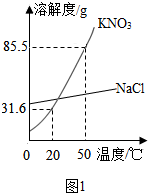 实验室需配置一定浓度的硝酸钾溶液,现实验室只有含少量NaCl的KNO3固体药品.KNO3和NaCl的溶解度曲线如图1所示,为达到实验目的,兴趣小组同学进行了下列系列实验:
实验室需配置一定浓度的硝酸钾溶液,现实验室只有含少量NaCl的KNO3固体药品.KNO3和NaCl的溶解度曲线如图1所示,为达到实验目的,兴趣小组同学进行了下列系列实验: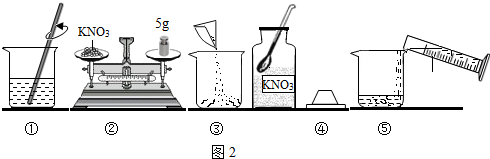
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
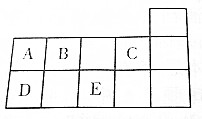 如图为元素周期表的一部分,A~E代表五种不同元素.
如图为元素周期表的一部分,A~E代表五种不同元素.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
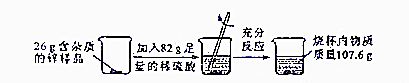
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com