
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCI | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |

分析 Ⅰ、根据两种物质在40℃时的溶解度进行分析;
根据溶质质量分数的计算公式进行分析;
Ⅱ、根据硝酸钾的溶解度随温度的升高而增大进行分析;
Ⅲ、根据20℃时,氯化钠的溶解度进行分析;
Ⅳ、①根据氯化钠的溶解度受温度的影响变化较小进行分析;
②根据饱和溶液的判断方法,以及溶液中溶剂的质量进行分析.
解答 解:Ⅰ、在40℃时,氯化钠的溶解度是36.6克,硝酸钾的溶解度是63.9克,所以硝酸钾的溶解度大,该温度时KNO3饱和溶液的质量分数为:$\frac{63.9g}{100g+63.9g}$×100%;
Ⅱ、硝酸钾的溶解度随温度的升高而增大,所以将KNO3的不饱和溶液转化为饱和溶液的方法是降低温度;
Ⅲ、20℃时,氯化钠的溶解度是36克,所以将20g NaCl放入50g水中,所得溶液的质量是50g+18g=68g;
Ⅳ、①氯化钠的溶解度受温度的影响变化较小,所以从NaCl溶液中得到NaCl晶体的方法是蒸发结晶;
②通过分析可知,A烧杯底部有固体,所以一定属于饱和溶液的是A,B中的溶质是40mL,C中的溶剂是20mL,A中的硫酸铜会形成硫酸铜晶体,所以溶液中溶剂质量的大小关系是:B>C>A.
故答案为:Ⅰ、硝酸钾,$\frac{63.9g}{100g+63.9g}$×100%;
Ⅱ、降低温度;
Ⅲ、68g;
Ⅳ、①蒸发结晶;
②A,B>C>A.
点评 本题难度不大,掌握理解溶解度的概念、结晶的方法并能灵活运用是正确解答本题的关键.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
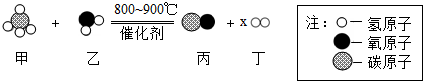
| A. | 该反应不属于置换反应 | |
| B. | 图示中x的值为3 | |
| C. | 反应前后氢元素的化合价发生了改变 | |
| D. | 反应中甲、丙两物质的质量比为2:7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、油脂维生素、无机盐和水.α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“一”表示原子之间相互连接).
维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、油脂维生素、无机盐和水.α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“一”表示原子之间相互连接).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
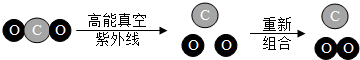
| A. | 属于分解反应 | B. | 反应中的最小微粒是分子 | ||
| C. | 符合质量守恒定律 | D. | 为制取氧气提供了新方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 项 目 | 空气污染指数 | 空气质量级别 | 空气质量描述 |
| 总悬浮颗粒 | 52 | Ⅱ | 良 |
| 二氧化硫 | 7 | ||
| 二氧化氮 | 24 |
| A. | 用天然气作燃料主要产生CO2 | |
| B. | 焚烧垃圾产生有毒气体 | |
| C. | 汽车排放的尾气含氮的氧化物 | |
| D. | 用煤和石油作燃料产生含硫的化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| CO32- | HCO3- | OH- | |
| Ba2+ | 不溶 | 溶 | 溶 |
| 步骤 | 操作 | 现象 | 结论 |
| 步骤1 | 取该NaOH溶液,加入过量BaCl2溶液 | 产生白色沉淀 | 证明猜想1、5不成立(填数字) |
| 步骤2 | 取步骤1中上层清液,滴加稀盐酸 | 无气泡产生 | 证明原溶液不含HC${{O}_{3}}^{-}$(填“离子”) |
| 步骤3 | 另取步骤1中上层清液,滴加酚酞 | 溶液未变红 | 证明原溶液不含OH-(填“离子”) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com