
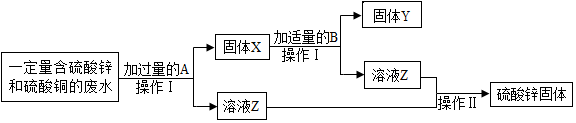
分析 (1)根据实验流程可知,该反应是回收铜和硫酸锌的实验,以及过滤需要的仪器进行分析;
(2)根据加入过量的锌可以使硫酸铜完全反应,但是过量的锌对于铜仍是杂质进行分析;
解答 解:(1)锌和硫酸铜反应生成硫酸锌和铜,所以加入的A是锌,所以X的成分为锌、铜,操作Ⅰ分离出了固体和溶液,所以操作I是过滤,需用的玻璃仪器有烧杯、玻璃棒和漏斗;
(2)加入过量的锌可以使硫酸铜完全反应,但是过量的锌对于铜仍是杂质,锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
故答案为:(1)锌、铜;漏斗;
(2)Zn+H2SO4=ZnSO4+H2↑.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的反应流程进行解答.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
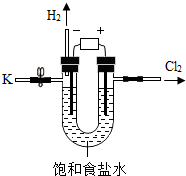 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.(提示:可以忽略其他可能发生的反应对以下实验的影响;Mg(OH)2在水中不溶)
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.(提示:可以忽略其他可能发生的反应对以下实验的影响;Mg(OH)2在水中不溶)
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | B. | Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | D. | AgNO3+NaCl═AgCl↓+NaNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论与解释 |
| ①向白醋滴入紫色石蕊 | 观察到溶液变红 | 白醋显酸性 |
| ②向镁粉中滴加白醋直至过量 | 镁条表面有大量气泡 | 白醋能与活泼金属反应 |
| ③将白醋滴加到碳酸钙表面 | 碳酸钙表面有气泡 | 反应的化学方程式是CaCO3+2CH3COOH═Ca(CH3COO)2+H2O+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用硫在密闭容器中燃烧,除去密闭容器内空气中的氧气 | |
| B. | 向某未知溶液中加入 AgNO3 溶液,产生白色沉淀,证明溶液是盐酸 | |
| C. | 按溶解、过滤、蒸发的操作顺序可以分离 CaCl2、CaCO3 的混合物 | |
| D. | 将 pH 试纸润湿后,用玻璃棒蘸取食用白醋滴到试纸上,测定其pH |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com