
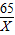 =
=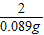
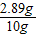 ×100%=28.9%<32%
×100%=28.9%<32%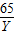 =
=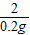
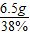 =17.1g
=17.1g

科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:
金属材料在生产、生活中有着广泛的应用。
 ⑴下列生活用品,主要利用金属具有良好导热性的是:___ ____。
⑴下列生活用品,主要利用金属具有良好导热性的是:___ ____。
A.铸铁炊具 B.金属细丝 C.铜制电缆 D.铁锤
⑵工业生产中,切割铁板时用硫酸铜溶液在铁板上画线可留下红色的印迹。有关反应的化学方程式为____ _ _。
⑶若要比较铁、锰、铜的金属活动性强弱,可选择的药品除了铁、铜单质外,还需要 。
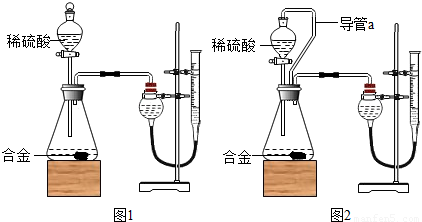
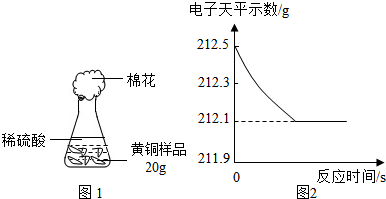
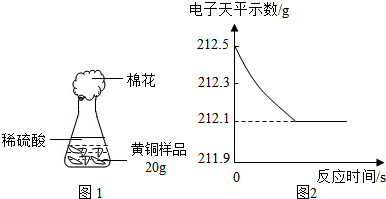
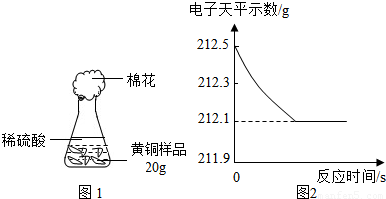
⑷研究性学习小组为了测定黄铜(铜、锌合金)的组成,用电子天平分别称得锥形瓶与棉花的质量为44.1g,称取黄铜
样品20.0g。在锥形瓶中加入该样品和足量稀硫酸后瓶口塞上棉花,如图1所示。将电子天平称量的数据绘成图2。
请认真分析数据,回答下列问题:
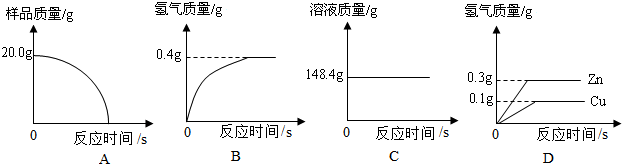
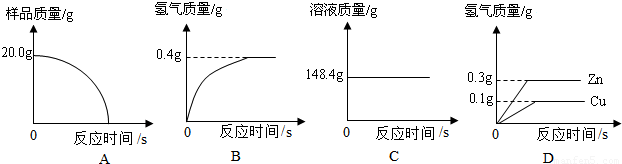
(Ⅰ)四个同学从多角度处理数据,下列数据处理的图像中正确的是 。
(Ⅱ)试计算:
①样品中铜的质量分数;②恰好反应时所得溶液中溶质的质量分数。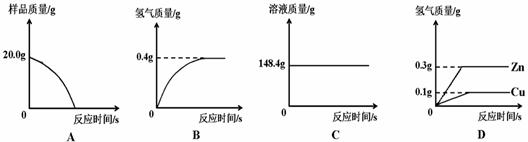

查看答案和解析>>
科目:初中化学 来源:2011年江苏省南京市建邺区中考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com