
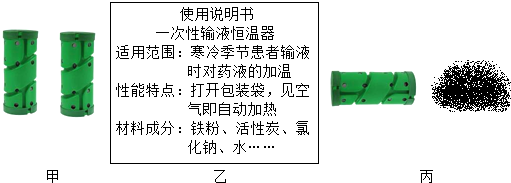
| A | B | C | D | |
| 实验方案 | 铁粉和水的混合物 | 在铁粉和水的混合物中加入ag活性炭,混匀后静置 | 在铁粉和水的混合物中加入ag氯化钠,混匀后静置 | 在铁粉和水的混合物中加入ag活性炭和ag氯化钠,混匀后静置 |
| 实验现象 | 铁粉较慢锈蚀 | 铁粉较快锈蚀 | 铁粉较快锈蚀 | 铁粉很快锈蚀 |
分析 根据已有的铁生锈的因素、促进铁生锈的因素以及物质间的反应进行分析解答.
解答 解:铁与水和氧气同时存在能生锈故填:与水和氧气同时接触.
[设计方案并实验]取一定质量的铁粉与水混合均匀,然后平均分成A、B、C、D四份,要验证是哪种物质加速铁的锈蚀,可以分别加入活性炭粉、氯化钠以及活性炭粉和氯化钠的混合物,故填:氯化钠;
[分析讨论]将实验A与B、实验A与C进行对比,得出活性炭和氯化钠均可加快铁的锈蚀;将实验D与实验BC进行对比,得出活性炭和氯化钠同时存在时铁的锈蚀速度更快.故填:BC;
[假设猜想]根据剩余黑色的粉末的成分,可能是炭粉,故填:炭粉;
[设计方案并实验]若是猜想三正确,则加入硫酸反应,有气泡产生,有黑色固体剩余,铁能与硫酸反应生成硫酸亚铁和氢气,故填:有固体剩余,Fe+H2SO4═FeSO4+H2↑;
[反思拓展]煤燃烧能产生大量的热,是化学能转化为热能,故填:煤燃烧.
点评 本题考查的是铁生锈因素的实验探究,完成此题,可以依据已有的知识进行.


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:解答题
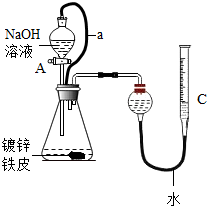 “白铁皮”是一种广泛应用于生产生活的金属材料. 某班级分两个兴趣小组开展了对“白铁皮”相关性质及应用的调查研究活动.
“白铁皮”是一种广泛应用于生产生活的金属材料. 某班级分两个兴趣小组开展了对“白铁皮”相关性质及应用的调查研究活动.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
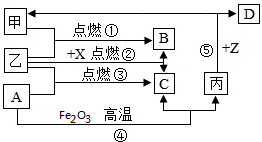 如图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物,常温下B为液态,化合物D的水溶液呈浅绿色.
如图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物,常温下B为液态,化合物D的水溶液呈浅绿色.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K+和OH-来自同一工厂 | B. | Cu2+和K+来自同一工厂 | ||
| C. | OH-和Cu2+来自同一工厂 | D. | H+和K+来自同一工厂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水的硬度太大,口感不好,容易使煮水的器具产生水垢 | |
| B. | 我市的饮用水的硬度没有超过国家的规定,是达标的 | |
| C. | 纯净水中没有钙镁化合物,所以用它洗衣服最合适 | |
| D. | 含有一定硬度的水可以补充钙元素,对人体是有益的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 这个变化的本质是分子破裂成了原子,原子重新组合成了新分子 | |
| B. | 在该变化过程中分子间的间隙增大,分子的数目增加 | |
| C. | 如果在该容器加入紫色石蕊试液,石蕊变成蓝色 | |
| D. | 可观察到容器的内外壁上有许多小水珠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
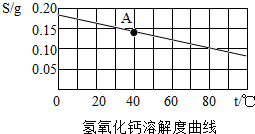 根据氢氧化钙的溶解度曲线,完成下列问题.
根据氢氧化钙的溶解度曲线,完成下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com