CaCO
3广泛存在于自然界,是一种重要的化工原料.某种大理石除主要成分为CaCO
3外,还有少量的硫化物.小平和小明同学用这种大理石和稀盐酸反应,分别开展以下探究,请你参与探究并回答相关问题.
[查阅资料]资料一:在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
| 溶质 |
H2SO4 |
HCl |
H2S |
H2CO3 |
HClO |
| pH |
小→大 |
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸.下列反应均能发生,其中不符合该规律的是
D
D
(填字母
A.H
2SO
4+2NaHCO
3=2NaCl+2H
2O+2CO
2↑ B.2HCl+CaS=CaC
2l+H
2S↑
C.CO
2+H
2O+Ca(ClO)
2=CaCO
3↓+2HClO D.H
2S+CuSO
4=H
2SO
4+CuS↓
资料二:CuS是黑褐色无定形粉末或粒状物,不溶于浓盐酸,不溶于水和硫化钠溶液.
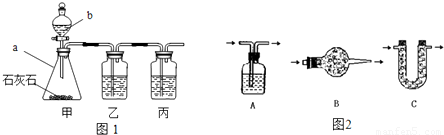
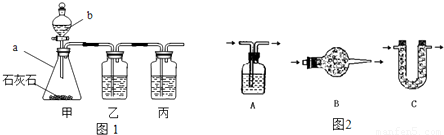
[实验探究]小平同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:
[制取CO
2]利用图1、与图2干燥装置制得纯净干燥的CO
2.
(1)仪器a的名称是
锥形瓶
锥形瓶
,仪器b的名称是
分液漏斗
分液漏斗
.装置甲中主要反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.
(2)装置丙盛有足量的饱和NaHCO
3溶液,目的是除去
氯化氢气体
氯化氢气体
.装置丙中主要反应的化学方程式为
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
.装置乙中盛有的物质是
CuSO4
CuSO4
溶液.现象:
出现黑褐色沉淀
出现黑褐色沉淀
.
(3)利用图2干燥装置干燥气体,常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰若选用A装置,则A装置中放入药品
①
①
(选择序号);若选用B装置,则B装置中放入药品
②
②
(选择序号).
(4)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
| 实验步骤 |
I将适量盐酸加入烧杯中并称量 |
II称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 |
III待反应完全后,称重 |
| 实验图示 |
 |
| 实验数据 |
烧杯和盐酸的质量为100.0g |
大理石样的质量为12.0g |
烧杯和其中混合物的质量为107.6g |
小明同学通过分析计算,得出结论:该实验中生成的二氧化碳的质量是4.4g.大理石样品纯度为83.3%.请你评价他的结论是否正确
错误
错误
,并简述理由
大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成碳酸钙的质量分数偏大
大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成碳酸钙的质量分数偏大
.



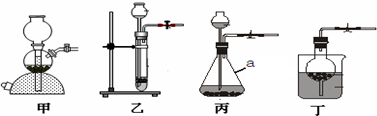
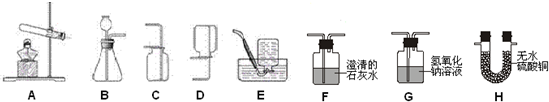


 (1)根据图1实验示意图回答问题:
(1)根据图1实验示意图回答问题: