
 ”为铜片).
”为铜片).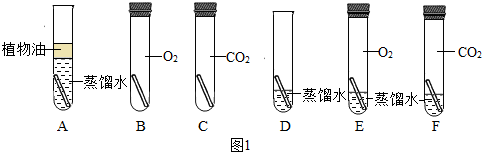
分析 (1)青铜器属于无机材料;
(2)铜绿受热分解生成氧化铜、水和二氧化碳;
(3)通过实验可以判断铜生锈的条件;
(4)不同的工艺流程,优缺点不同;
(5)氧化铜和稀硫酸反应生成硫酸铜和水;
(6)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类、总个数和质量都不变;
(7)根据图中提供的信息可以判断相关方面的问题;
(8)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
二氧化碳能够溶于水,不溶于植物油;
(9)根据提供的数据、信息等可以进行相关方面的计算和判断.
解答 解:(1)青铜器属于无机材料.
故选:A.
(2)铜绿分解生成氧化铜、水和二氧化碳,反应的化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑.
故填:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑.
(3)实验较长时间后,发现D试管中铜片最先生锈;
小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验,要补充的一个实验是:Cu和CO2、O2充分接触;
可以省略不做的实验是试管ABC.
故填:D;CO2、O2;ABC.
(4)上述两种方法中,更好的是方法二 ,原因是能耗低,不产生二氧化硫这种污染空气的气体等;
设需要含Cu2S 80%的辉铜矿质量为x,
根据题意有:x×80%×$\frac{128}{160}$×100%×90%=64t,
x=111t,
辉铜矿的主要成分为Cu2S,常用于火法炼铜.若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S 80%的辉铜矿 111 t(取整数).
故填:方法二;能耗低;111.
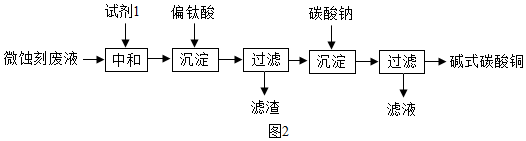
(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用氧化铜,这是因为氧化铜能够除去硫酸,不带入新的杂质.
故选:c.
(6)根据质量守恒定律,反应的化学方程式为:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5Na2SO4.
故填:Na2SO4.
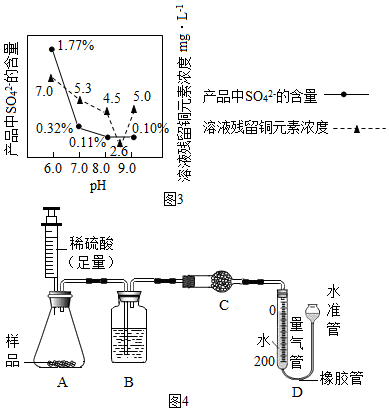
(7)由图3所示可知,溶液pH为8.5左右时,硫酸根离子含量最低,溶液中铜离子沉淀效率最高,因此第二次沉淀时溶液pH最好控制在8.5.
故填:8.5.
(8)实验步骤如下:①连接装置并检查装置气密性;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10ml;④向锥形瓶内加入50ml(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml.
Ⅱ.装置B的作用是干燥二氧化碳,少量植物油的作用是防止二氧化碳溶于水,C中的试剂是无水硫酸铜,用来检验二氧化碳中是否含有水蒸气;
Ⅲ.步骤⑥中调节液面相平的操作是将水准管缓慢下移.
故填:检查装置气密性;干燥二氧化碳;防止二氧化碳溶于水;c;缓慢下移.
Ⅳ.反应生成二氧化碳质量为:(172mL-50mL-10mL)÷1000÷22.4L×44g=0.22g,
设碳酸铜质量为y,
CuCO3+H2SO4═CuSO4+H2O+CO2↑,
124 44
y 0.22g
$\frac{124}{y}$=$\frac{44}{0.22g}$,
y=0.62g,
产品中CuCO3的质量分数为:$\frac{0.62g}{1.2g}$×100%=51.7%,
答:产品中CuCO3的质量分数为51.7%.
Ⅴ.A.步骤③中平视刻度,步骤⑥中仰视读数,会导致测定结果偏大;
B.硫酸的用量不足,会导致测定结果偏小;
C.量气管中未加植物油,会导致测定结果偏小;
D.步骤⑥中没有调节量气装置两边液面相平,直接读数,会导致测定结果偏小.
故填:BCD.
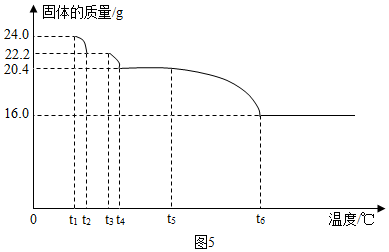
(9)加热时,结晶水先失去,因此结晶水的质量为:24.0g-22.2g=1.8g;
设氢氧化铜质量为z,
Cu(OH)2的分解温度小于CuCO3的分解温度,因此氢氧化铜完全反应后生成水的质量为:22.2g-20.4g=1.8g;
Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,
98 18
z 1.8g
$\frac{98}{z}$=$\frac{18}{1.8g}$,
z=9.8g,
设碳酸铜质量为m,
碳酸铜分解生成二氧化碳质量为:20.4g-16.0g=4.4g,
CuCO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+CO2↑,
124 44
m 4.4g
$\frac{124}{m}$=$\frac{44}{4.4g}$,
m=12.4g,
根据题意有:$\frac{12.4g}{124}$:$\frac{9.8g}{98}$=x:y,$\frac{9.8g}{98}$:$\frac{1.8g}{18}$=y:z,
通过计算可得:x:y:z=1:1:1;
若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,说明反应过程中氧化铜中的氧元素一部分转化成氧气,剩余固体中铜元素质量为:16.0g×$\frac{64}{80}$×100%=12.8g,
剩余固体中氧元素质量为:16.0g-12.8g-1.6g=1.6g,
设固体的化学式为CumOn,
根据题意有:64m:16n=12.8g:1.6g,
m:n=2:1,
因此剩余固体的化学式是Cu2O,
此过程中可能发生反应的化学方程式为:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑.
故填:1:1:1;4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源:【全国区级联考】广东省深圳市坪山新区2017届九年级下学期第二次调研化学试卷 题型:选择填充题
下列图像能正确反映对应变化关系的是( )
A. 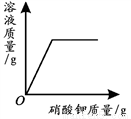 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
B. 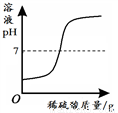 向一定量NaOH溶液中加入稀H2SO4
向一定量NaOH溶液中加入稀H2SO4
C. 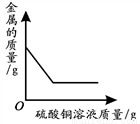 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
向一定量铁粉和铜粉的混合物中加入硫酸铜溶液
D. 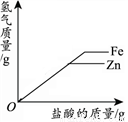 向相同质量的锌粉和铁粉中,分别加入足量的稀盐酸
向相同质量的锌粉和铁粉中,分别加入足量的稀盐酸
查看答案和解析>>
科目:初中化学 来源:2017届山东省日照市莒县九年级下学期第二次学业水平模拟测试化学试卷(解析版) 题型:信息分析题
金属和金属材料在生活、生产中应用广泛。
(1)铁在潮湿的空气中容易生锈,实际上是与空气中的_____________等发生了化学反应;
(2)用Fe、Ag和________溶液(填序号),可以一次性验证Fe、Cu、Ag三种金属的活动性顺序。写出有关反应的化学方程式___________________________。
①AgNO3溶液 ②CuSO4溶液; ③Al2(SO4)3溶液
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 选项 | 方法 | 示例 |
| A | 实验法 | 用硫做“测定空气中氧气含量”的实验 |
| B | 归纳法 | 根据NaOH溶液、Ca(OH)2溶液等物质的化学性质,归纳出碱的通性 |
| C | 类比法 | 根据金属铁能与稀盐酸反应,推测金属铜也能与稀盐酸反应 |
| D | 分类法 | 根据组成物质的元素种类,将纯净物分为单质与化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滤液中一定含有Zn2+,可能含有Cu2+ | |
| B. | 所得滤渣质量可能等于加入的Zn粉和Cu粉质量 | |
| C. | 如果滤渣中有Zn,则滤液可能为浅绿色 | |
| D. | 如果滤液中含有Ag+,则滤渣一定为纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 黄酮素是由黄酮素分子构成的 | |
| B. | 氧元素的质量分数为9.0% | |
| C. | 黄酮素是由15个碳原子、10个氢原子和2个氧原子构成的 | |
| D. | 黄酮素中碳、氢、氧元素的质量比为15:10:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用亚硝酸钠做调味品 | B. | 用甲醛浸泡海产品保鲜 | ||
| C. | 用工业染料制作彩色馒头 | D. | 用含小苏打的发酵粉焙制糕点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com