
分析 【猜想与假设】根据“①2Na2O2+2H2O═4NaOH+O2↑,②2Na2O2+2CO2═2Na2CO3+O2”,推测猜想与假设①为Na2CO3;
【定性研究】实验Ⅰ:根据2Na2O2+2H2O═4NaOH+O2↑,固体中有Na2O2,确定实验现象;
根据证明固体中含有NaOH,酚酞试液的变色规律,确定实验现象;
【反思评价】实验Ⅰ中的现象和结论属于一一对应关系;其它实验中的现象对应的结论还有另外的可能性;
【实验结论】根据过氧化钠与水反应能生成氢氧化钠和氧气,反应前后减少的质量为生成的氧气的质量,利用氧气的质量求出过氧化钠的质量,从而求出2.62g固体中碳酸钠的质量进行分析解答;
【延伸拓展】(1)根据碳酸钠与足量的稀盐酸,产生大量气泡,再通入澄清的石灰水,若变浑浊;
(2)利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应进行分析解答.
解答 解:【猜想与假设】根据“①2Na2O2+2H2O═4NaOH+O2↑,②2Na2O2+2CO2═2Na2CO3+O2”,则推测猜想与假设①为Na2CO3;
【定性研究】实验Ⅰ:因为2Na2O2+2H2O═4NaOH+O2↑,取少量固体放入试管中,加足量水,看到固体溶解,有气泡产生(或将带火星的木条伸入试管中,木条复燃),证明固体中有Na2O2.
实验Ⅳ:因为碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠;取少量固体放入试管中,加足量水,再滴加足量的氯化钙溶液后,过滤出碳酸钙,再向滤液中加入酚酞试液,若溶液变成红色,则证明原固体中含有NaOH.
【反思评价】
有些同学认为通过实验Ⅱ并不能确定固体中含有Na2CO3;还有些同学认为通过实验Ⅲ也不能证明固体中一定含有NaOH.其原因是:2Na2O2+2H2O═4NaOH+O2↑,影响氢氧化钠的判定;上述根据现象得出结论正确的实验是实验Ⅰ;
【定量研究】根据过氧化钠与水反应能生成氢氧化钠和氧气,反应前后减少的质量为生成的氧气的质量,氧气的质量=2.62g+20g-22.3g=0.32g
设过氧化钠的质量为y
2Na2O2+2H2O═4NaOH+O2↑
156 32
y 0.32g
$\frac{156}{y}=\frac{32}{0.32g}$
y=1.06
假设2.62g固体是过氧化钠和碳酸钠的混合物,则碳酸钠的质量=2.62g-1.56g=1.06
设产生沉淀的质量为x
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
106 100
1.06g x
$\frac{106}{1.06g}=\frac{100}{x}$
x=1g
【实验结论】故当X的数值范围是0<X<1时,猜想假设④成立.
【延伸拓展】(1)由于Na2O2能分别与H2O和CO2反应生成O2,并放出大量的热量,得到的氧气中有大量的水蒸气.
(2)CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量,
所以Na2O2增重的质量为CO与H2混合气体的质量,充分反应后固体质量为M+N.
故答案为:
【猜想假设】Na2CO3;
【定性研究】有气泡产生(或将带火星的木条伸入试管中,木条复燃),红;
【反思评价】实验Ⅰ;
【实验结论】0<X<1;
【延伸拓展】(1)反应放热,得到的氧气中有大量的水蒸气;
(2)M+N.
点评 该考点的命题方向主要是以实验探究题的形式,给出有关的信息提示,让学生通过实验探究,分析推断出该物质的组成成分;中考的重点是考查学生通过实验的方法来研究物质的组成成分以及含量能力.


科目:初中化学 来源: 题型:选择题
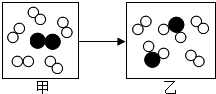 如图是某个化学反应的微观模拟图,甲表示反应前的状态,乙表示反应后的状态,下列关于该反应的说法正确的是( )
如图是某个化学反应的微观模拟图,甲表示反应前的状态,乙表示反应后的状态,下列关于该反应的说法正确的是( )| A. | 甲、乙分子总数不变 | B. | 乙比甲原子总数减少 | ||
| C. | 甲的质量大于乙的质量 | D. | 该反应是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气浓度越大可燃物燃烧的越剧烈 | |
| B. | 只要温度达到可燃物的着火点可燃物就能燃烧 | |
| C. | 可燃物燃烧的反应一定是化合反应 | |
| D. | 家庭中电器着火应立即用水扑灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化学计量数a与b之和一定等于c与d之和 | |
| B. | 反应物A与B的质量比一定等于C与D是质量比 | |
| C. | 若A和C都是盐,则一定是复分解反应 | |
| D. | 若xgA与xgB反应生成C与D的质量之和不一定等于2xg |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +4 | B. | +1 | C. | +2 | D. | +3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质(少量) | 选用试剂 | 操作方法 |
| A | N2 | O2 | 铜网 | 将混合气体缓缓通过灼热的铜网 |
| B | KC1 | k2SO4 | 稀硫酸 | 加入过量的稀硫酸、蒸发 |
| C | KNO3 | NaCl | 热水 | 溶解、蒸发结晶、过滤 |
| D | KMn04 | Mn02 | 足量的水 | 溶解、过滤、洗涤、烘干 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | C | CuO | 加入适量稀盐酸,过滤 |
| B | Cu粉 | Fe粉 | 用磁铁吸出 |
| C | KCl溶液 | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | O2 | 水蒸气 | 通过浓H2SO4洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com