


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 27、某兴趣小组在探究金属与酸的反应时发现了意外情况:铜能与稀硫酸反应--将一小块铜片放入试管中,加入适量稀硫酸,无现象;加热该试管,较长时间后铜片上有气泡,溶液逐渐变成了蓝色.
27、某兴趣小组在探究金属与酸的反应时发现了意外情况:铜能与稀硫酸反应--将一小块铜片放入试管中,加入适量稀硫酸,无现象;加热该试管,较长时间后铜片上有气泡,溶液逐渐变成了蓝色.
查看答案和解析>>
科目:初中化学 来源: 题型:
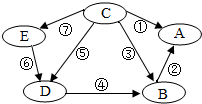 (2013?广东模拟)A,B,C,D,E是初中化学中常见的五种物质,它们都含有一种相同的元素,如图表示各物质之间的转化关系.其中,A为食盐的主要成分,B中含钡元素,D,E为有颜色的溶液,其他物质的溶液都为无色;⑤和⑥为置换反应,其他均为复分解反应.
(2013?广东模拟)A,B,C,D,E是初中化学中常见的五种物质,它们都含有一种相同的元素,如图表示各物质之间的转化关系.其中,A为食盐的主要成分,B中含钡元素,D,E为有颜色的溶液,其他物质的溶液都为无色;⑤和⑥为置换反应,其他均为复分解反应.查看答案和解析>>
科目:初中化学 来源: 题型:
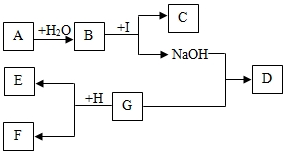
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com