
| A. | 负极产生的气体可以燃烧 | |
| B. | 产生的H2与O2的质量比为2:1 | |
| C. | 实验证明了分子在化学变化中可分 | |
| D. | 证明了水是由氢、氧元素组成的化合物 |
分析 根据电解水的实验现象可知,与电源正极相连的产生的气体能使带火星木条复燃为氧气,与电源负极相连的一端产生的气体为能燃烧的氢气,且两种气体的体积比为1:2;由此实验可说明水由氢、氧元素组成,可以据此答题.
解答 解:
A、根据实验现象可以知道与负极相连的产生的气体是氢气,能够燃烧,故对.
B、正极和负极产生的气体体积之比为1:2,不是质量之比,故错.
C、化合反应的实质是在化学反应中,分子在化学变化中可分,原子不能再分,只能重新结合为新分子,故对.
D、通电分解水只产生了氧气和氢气,根据化学反应的实质可以知道水是由氢元素和氧元素组成的,故对.
故选B.
点评 熟练掌握水电解的实验及结论,具体的可以用六个字来描述记忆“正氧一负氢二”,一和二指的是体积之比为1:2,而不是质量之比.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
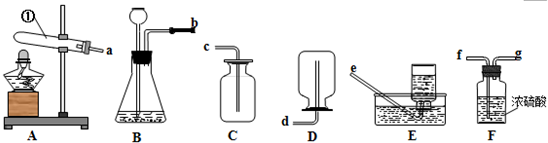
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 氯化钾溶液 | 氯化铁 | 加入氢氧化钠溶液至不再产生沉淀 |
| B | 氢氧化钠溶液 | 氢氧化钙 | 通入二氧化碳气体至不再产生沉淀 |
| C | 盐酸 | 硫酸 | 加入氯化钡至不再产生沉淀 |
| D | 氯化钠溶液 | 碳酸钠 | 加入过量的盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
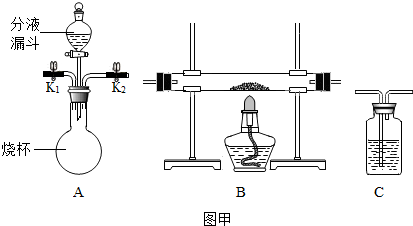
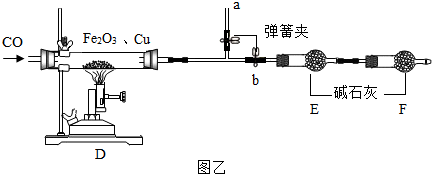
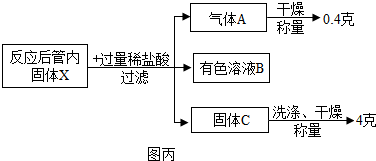
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com