纯碱是重要的化工原料
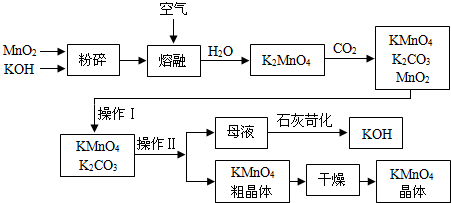
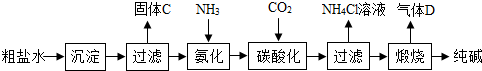
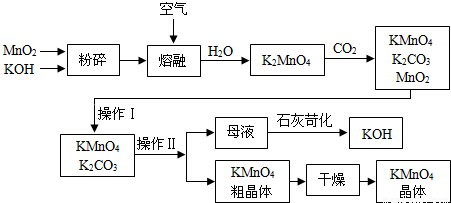
(一)制备探究:如图是工业生产纯碱的主要流程示意图.
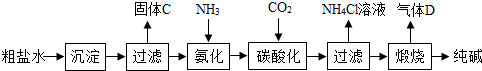
[查阅资料]
①粗盐水中含有杂质MgCl
2、CaCl
2;
②常温下,NH
3极易溶于水,CO
2能溶于水,
③NaHCO
3加热易分解,Na
2CO
3加热不易分解.
(1)写出除去粗盐水中MgCl
2、CaCl
2的化学方程式:
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
,
CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
有利于溶液吸收CO2气体
有利于溶液吸收CO2气体
,“碳酸化”时,NaCl、NH
3、CO
2 和H
2O相互作用析出NaHCO
3,写出该反应的化学方程式
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
.
(3)“碳酸化”后过滤获得的NH
4Cl可用作
氮
氮
肥,也可先
加热
加热
(填“加热”或“冷却”)NH
4Cl溶液,再加入熟石灰获得循环使用的物质是
NH3(或氨气)
NH3(或氨气)
;
(4)煅烧制得纯碱的化学方程式是
(二)成分探究
[提出问题]纯碱样品中含有哪些杂质?
[猜想]猜想一:可能含有NaHCO
3; 猜想二:可能含有NaCl;
猜想三:
NaHCO3和NaCl
NaHCO3和NaCl
[实验探究]确定纯碱中是否含NaHCO
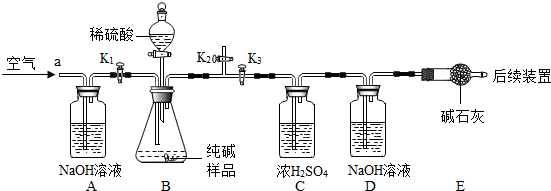
3.实验装置和主要实验步骤如下:
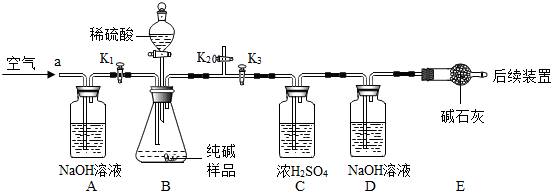
①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K
1和K
2,关闭K
3,缓缓鼓入一段时间空气;
②关闭活塞K
1和K
2,打开K
3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K
1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
[实验讨论]
(5)加入样品前还应
检查装置气密性
检查装置气密性
;
(6)装置A的作用是
除去空气中的二氧化碳
除去空气中的二氧化碳
,装置C的作用是
除去二氧化碳中的水
除去二氧化碳中的水
;装置E的作用是
吸收从D中带出的水
吸收从D中带出的水
;
(7)反应结束后打开止水夹K
1,缓缓鼓入空气的目的是
将生成的二氧化碳全部送到D中
将生成的二氧化碳全部送到D中
,装置B中一定发生的化学反应方程式为
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
装置D中的化学反应方程式为
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
.
(8)装置B中生成CO
2的质量为
4.84
4.84
g.通过计算说明纯碱中
A
A
含NaHCO
3(填字母).
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知Na
2CO
3相对分子质量为106、NaHCO
3相对分子质量为84):
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 44
10.6g x
=x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠.
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 44
10.6g x
=x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠.
(9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足
W>0.32a
W>0.32a
条件时,样品中含有NaCl.