
(10分) 某课外活动小组利用稀硫酸测定粗锌中锌的含量。现称取粗锌20g,加入到足量硫酸溶液中充分反应(杂质不参与反应),测得数据如下表:
|
时间/min |
0 |
3 |
6 |
9 |
|
粗锌及溶液总质量/g |
150.4 |
150.2 |
150.0 |
150.0 |
1)涉及的化学方程式为 ;
2)计算反应过程中产生氢气的质量为 ;
3)根据表中数据计算粗锌中锌的质量分数。
1)Zn+H2SO4=ZnSO4+H2↑ ; 2)0.4g; 3)65%
【解析】
试题分析:根据题意书写反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,由于该反应有气体生成,结合质量守恒定律可知,反应前后粗锌及溶液总质量会减小,且减少的质量即为氢气的质量,而后利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,最后可求出粗锌中锌的质量分数。
根据表格可知,到6分钟以后,粗锌及溶液总质量不再改变,说明已完全反应,由此可知,反应生成的氢气的质量为150.4g-150.0g=0.4g。
设20g粗锌中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
65:x=2:0.4g
解得x=13g
则粗锌中锌的质量分数=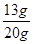 ×100%=65%
×100%=65%
考点:根据化学反应方程式的计算
点评:本题主要考查含杂质物质的化学方程式计算,要想解答好这类题目,就要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等,此外还要能够利用质量守恒定律分析反应前后质量变化,从而得到反应生成氢气的质量,这也是解答本题的关键。


 名师指导一卷通系列答案
名师指导一卷通系列答案科目:初中化学 来源: 题型:
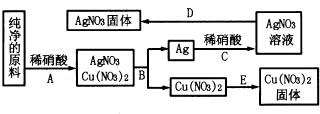
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
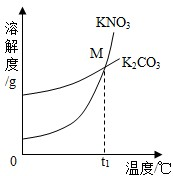 (2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
(2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
| 稀硫酸 |
| △ |
| 浓硫酸 |
| △ |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 时间/min | 0 | 3 | 6 | 9 |
| 粗锌及溶液总质量/g | 150.4 | 150.2 | 150.0 | 150.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com