
 ŌŚ”°ŗīŹ½ĮŖŗĻÖĘ¼ī·Ø”±µÄ¹¤ŅÕĮ÷³ĢÖŠ£¬×īŗóŅ»²½ŹĒÓĆ¼ÓČČĢ¼ĖįĒāÄʵķ½·ØĄ“ÖĘČ”“æ¼ī£®Ä³“æ¼īÉś²ś³§ÖʵƵÄѳʷNa2CO3ÖŠ»ģÓŠÉŁĮæNaHCO3£®ĪŖĮĖ²ā¶Øѳʷ֊Na2CO3µÄÖŹĮæ·ÖŹż£¬Č”100g»ģŗĻĪļ¼ÓČČ£Ø2NaHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$Na2CO3+H2O+CO2”ü£¬Na2CO3ŹÜČČ²»·Ö½ā£©£¬·“Ó¦¹ż³ĢÖŠÉś³É¶žŃõ»ÆĢ¼ĘųĢåµÄÖŹĮæÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®
ŌŚ”°ŗīŹ½ĮŖŗĻÖĘ¼ī·Ø”±µÄ¹¤ŅÕĮ÷³ĢÖŠ£¬×īŗóŅ»²½ŹĒÓĆ¼ÓČČĢ¼ĖįĒāÄʵķ½·ØĄ“ÖĘČ”“æ¼ī£®Ä³“æ¼īÉś²ś³§ÖʵƵÄѳʷNa2CO3ÖŠ»ģÓŠÉŁĮæNaHCO3£®ĪŖĮĖ²ā¶Øѳʷ֊Na2CO3µÄÖŹĮæ·ÖŹż£¬Č”100g»ģŗĻĪļ¼ÓČČ£Ø2NaHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$Na2CO3+H2O+CO2”ü£¬Na2CO3ŹÜČČ²»·Ö½ā£©£¬·“Ó¦¹ż³ĢÖŠÉś³É¶žŃõ»ÆĢ¼ĘųĢåµÄÖŹĮæÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®·ÖĪö øł¾Ż¶žŃõ»ÆĢ¼µÄÖŹĮææÉŅŌ¼ĘĖćĢ¼ĖįĒāÄʵÄÖŹĮ棬½ųŅ»²½æÉŅŌ¼ĘĖćĢ¼ĖįÄʵÄÖŹĮæ¼°ĘäÖŹĮæ·ÖŹż£®
½ā“š ½ā£ŗ£Ø1£©ÓÉĶ¼ÖŠŠÅĻ¢æÉÖŖ£¬Éś³É¶žŃõ»ÆĢ¼ÖŹĮæŹĒ0.22g£®
¹ŹĢī£ŗ0.22£®
£Ø2£©ÉčĢ¼ĖįĒāÄĘÖŹĮæĪŖx£¬
2NaHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$Na2CO3+H2O+CO2”ü£¬
168 44
x 0.22g
$\frac{168}{x}$=$\frac{44}{0.22g}$£¬
x=0.84g£¬
ѳʷ֊Na2CO3µÄÖŹĮæ·ÖŹżĪŖ£ŗ$\frac{100g-0.84g}{100g}$”Į100%=99.16%£¬
“š£ŗѳʷ֊Na2CO3µÄÖŹĮæ·ÖŹżĪŖ99.16%£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éѧɜŌĖÓĆ¼ŁÉč·ØŗĶ»Æѧ·½³ĢŹ½½ųŠŠ¼ĘĖćŗĶĶʶĻµÄÄÜĮ¦£¬¼ĘĖ揱ŅŖ×¢Ņā¹ę·¶ŠŌŗĶ×¼Č·ŠŌ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ČēĶ¼±ķŹ¾Ņ»ĘæĢ¼ĖįÄĘČÜŅŗ£¬ĒėÓĆÕżČ·µÄ»Æѧ·ūŗÅĢīæÕ£ŗ
ČēĶ¼±ķŹ¾Ņ»ĘæĢ¼ĖįÄĘČÜŅŗ£¬ĒėÓĆÕżČ·µÄ»Æѧ·ūŗÅĢīæÕ£ŗ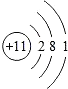 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
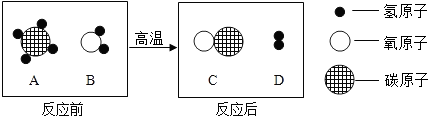
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
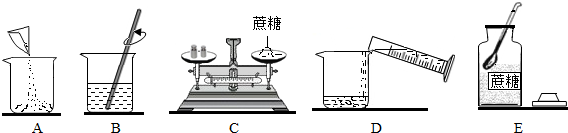
| A£® | »īŠŌĢæÓĆ×÷Īüø½¼Į | B£® | øɱłÓĆÓŚČĖ¹¤½µÓź | ||
| C£® | ·ŹŌķĖ®ÓĆÓŚĒų±šÓ²Ė®ŗĶČķĖ® | D£® | ŅŗĢ¬µŖ×÷ÖĘĄä¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
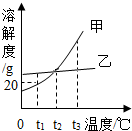 øł¾ŻČēĶ¼µÄČܽā¶ČĒśĻߣ¬ÅŠ¶ĻĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
øł¾ŻČēĶ¼µÄČܽā¶ČĒśĻߣ¬ÅŠ¶ĻĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ¼×ĪļÖŹµÄČܽā¶ČĖęĪĀ¶ČµÄÉżø߶ųŌö“ó | |
| B£® | t1”ꏱ£¬¼×µÄ±„ŗĶČÜŅŗÖŠČÜÖŹŗĶČܼĮµÄÖŹĮæ±ČĪŖ1£ŗ5 | |
| C£® | t2”ꏱ£¬¼×”¢ŅŅĮ½ĪļÖŹµÄČܽā¶ČĻąµČ | |
| D£® | ½«t3”ꏱ¼×”¢ŅŅĮ½ĪļÖŹµÄ±„ŗĶČÜŅŗ½µĪĀµ½t1”ę£¬¼×Īö³öµÄ¾§Ģå¶ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com