
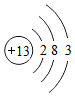 .A原子在化学反应中容易失去电子变成阳离子;B元素的离子结构示意图为:
.A原子在化学反应中容易失去电子变成阳离子;B元素的离子结构示意图为: ,该离子带1个单位负电荷.
,该离子带1个单位负电荷. 分析 原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子.
解答 解:由A原子结构示意图为可以看出:最外层弧线上的数字是3,原子最外电子层上有3个电子,在化学反应中易失去3个电子而形成阳离子.
由B原子结构示意图为可以看出,质子数=17,核外电子数=18,质子数<核外电子数,为带1个单位负电荷的阴离子.
故答案为:失去;阳;1.
点评 本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.


科目:初中化学 来源: 题型:多选题
| 选项 | 所用试剂或用品 | 现象和结论 |
| A | 氯化镁溶液 | 出现白色沉淀,则氢氧化钠过量 |
| B | 硝酸钡溶液 | 出现白色沉淀,则硫酸过量 |
| C | 铁片 | 有气泡产生,则硫酸过量 |
| D | pH试纸 | 试纸显蓝色,则恰好完全反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 第1次 | 第2次 | |
| 加入稀硫酸的质量/g | 200 | 200 |
| 烧杯内物质的质量/g | 212.5 | 412.25 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
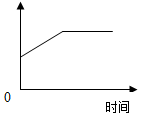 铜锈的主要成分是碱式碳酸铜[Cu2(OH)2 CO3].取一定量的碱式碳酸铜于试管,加热生成三种氧化物,随着反应的发生,如图纵坐标表示的是( )
铜锈的主要成分是碱式碳酸铜[Cu2(OH)2 CO3].取一定量的碱式碳酸铜于试管,加热生成三种氧化物,随着反应的发生,如图纵坐标表示的是( )| A. | 生成物的质量 | B. | 铜元素的质量分数 | ||
| C. | 分子的种类和数目 | D. | 黑色固体物质的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2HCl+CuO═CuCl2+H2O | B. | 2NaOH+CO2═Na2CO3+H2O | ||
| C. | 2HCl+Cu (OH)2═CuCl2+2H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
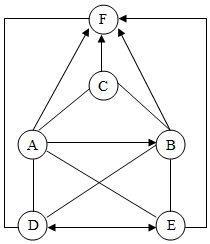 已知A、B、C、D、E、F是初中常见的六种物质.B中溶质含有两种元素,(物质之间的“-”表示能反应,“→”表示以转化)C为难溶于水的固体,A、C反应的生成物可配制波尔多液,E可用于制造玻璃.试回答下列问题:
已知A、B、C、D、E、F是初中常见的六种物质.B中溶质含有两种元素,(物质之间的“-”表示能反应,“→”表示以转化)C为难溶于水的固体,A、C反应的生成物可配制波尔多液,E可用于制造玻璃.试回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com