
【题目】向氢氧化钠溶液中通入二氧化碳,反应的化学方程式为________,实验没有明显现象,若要证明两者发生了化学反应,你采取的实验方法是_______。
(1)但某同学在常温下向饱和的氢氧化钠溶液中通入二氧化碳时,发现溶液中出现了白色沉淀。同学们对此现象产生了浓厚的兴趣,准备对产生此现象的原因进行探究。
(查阅资料)①常温下部分物质的溶解度
物质名称 | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 |
溶解度(单位:g) | 109 | 21.5 | 9.6 |
②在碳酸钠溶液中不断通入二氧化碳可发生如下反应:Na2CO3+CO2+H2O=2NaHCO3
③碳酸氢钠溶液显碱性。
(提出问题)产生的白色沉淀是什么?
(提出猜想1)猜想①:可能是碳酸钠;猜想②:可能是碳酸氢钠;猜想③:可能是________
(设计实验1)小明向白色沉淀中加入大量水溶解得到溶液。向溶液中加入过量氯化钡溶液,观察到_____,过滤,向滤液中加入________,观察到溶液变为红色,得出结论猜想③成立。
(进一步探究)在氢氧化钠溶液中通入二氧化碳产生沉淀物与什么因素有关?
(提出猜想2)猜想①:可能与氢氧化钠溶液的浓度有关;猜想②:可能与通入的CO2气体量的多少有关。
(设计实验2)
(2)请帮助小明设计实验验证猜想①是否成立。
你的实验方案是:________
实验现象:________
实验结论:与NaOH溶液的浓度有关。
(3)进一步实验发现与通入的CO2气体量的多少也有关,最终得出猜想②也成立。
(拓展提升)向饱和的碳酸钠溶液中通入CO2气体,也有白色沉淀生成。
(4)分析生成沉淀的原因______,根据实验结论,写出一种鉴别饱和碳酸钠和碳酸氢钠溶液的方法____
(5)实验发现常温下,在一定溶质质量分数的碳酸钠溶液中通入足量的二氧化碳就能出现沉淀现象,该碳酸钠溶液的溶质质量分数应高于______(计算结果精确到0.1%)。
【答案】2NaOH+CO2=Na2CO3+H2O 向反应后的溶液中加过量稀盐酸,若有气泡冒出,则证明两者发生了化学反应(合理即可) 碳酸钠和碳酸氢钠 有白色沉淀生成 无色酚酞溶液 在相同体积的稀NaOH溶液和饱和NaOH溶液中分别通入等体积过量的CO2气体 稀NaOH溶液不变浑浊,饱和NaOH溶液变浑浊 生成的碳酸氢钠在常温下溶解度小,结晶析出 向样品溶液中分别通入过量CO2,若变浑浊则为饱和碳酸钠溶液,若无明显现象,则为饱和碳酸氢钠溶液 5.7%
【解析】
向氢氧化钠溶液中通入二氧化碳,反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O,实验没有明显现象,若要证明两者发生了化学反应,证明有碳酸钠生成即可。采取的实验方法:取反应后的溶液滴入过量稀盐酸,观察到有气泡产生,是因为二氧化碳和氢氧化钠反应生成的碳酸钠能和稀盐酸反应生成二氧化碳气体。
(1)提出猜想:
猜想:可能是碳酸钠;猜想②:可能是碳酸氢钠;猜想③:可能是碳酸钠和碳酸氢钠;
设计实验1:
向溶液中加入过量氯化钡溶液,观察到产生白色沉淀,是因为碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠过滤,向滤液中加入酚酞试液,观察到溶液变为红色,说明溶液中含有碳酸氢钠(显碱性,可以使酚酞试液变红),得出结论猜想③成立;
设计实验2:
(2)猜想①:可能与氢氧化钠溶液的浓度有关;
实验方案是:分别向等体积饱和氢氧化钠溶液和稀氢氧化钠溶液中通入等体积二氧化碳;
实验现象:稀NaOH溶液不变浑浊,饱和NaOH溶液变浑浊;
实验结论:与NaOH溶液的浓度有关;
(4)生成沉淀的原因:碳酸钠和水、二氧化碳反应生成碳酸氢钠,常温下碳酸氢钠的溶解度远小于碳酸钠的溶解度,结晶析出;鉴别饱和碳酸钠和碳酸氢钠溶液的方法:向溶液中不断通入二氧化碳气体,产生沉淀的溶液是碳酸钠溶液,不产生沉淀的溶液是碳酸氢钠溶液。
(5)设碳酸钠溶液质量是1g,溶质质量分数是x,根据题意有:
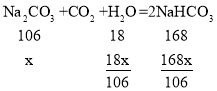
当形成的碳酸氢钠溶液恰好饱和时有: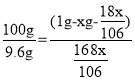 ,x≈5.7%
,x≈5.7%
即当碳酸钠溶液的溶质质量分数大于5.7%时才能够产生沉淀。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:
【题目】下列图象反映的变化规律与其对应操作不相符的是
A. 向氯化钠的饱和溶液中加入氯化钾
B. 向灼热的赤铁矿中通入CO
C. 向等质量的Al和Mg中加入足量的等质量等溶质质量分数的稀盐酸
D. 将饱和的氯化钠溶液恒温蒸发水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是
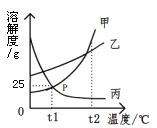
A. P点表示甲、丙两种物质的饱和溶液质量相等
B. t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液
C. t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4
D. 将三种物质的溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向装有等量水的A、B、C三个烧杯中分别加入10g、25g、25 g NaNO3固体,在不同温度下充分溶解后,现象如图1所示。
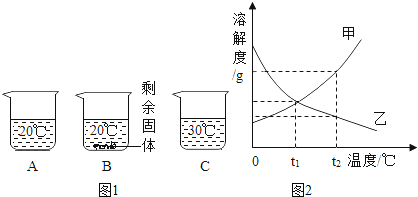
(1)烧杯中的溶液一定属于饱和溶液的是__________(选填“A”、“B”或“C”序号)。
(2)图2中能表示NaNO3溶解度曲线的是____________(填“甲”或“乙”)。
(3)要使B烧杯中剩余的固体继续溶解,可采用的方法是__________。
(4)由上图2分析,若分别将100g甲、乙两物质的饱和溶液从t2℃降温到t1℃,对所得溶液的分析正确的是__________(填序号)。
A甲、乙都是饱和溶液 B所含溶剂质量:甲<乙
C溶液质量:甲>乙 D溶质质量分数:甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法不正确的是
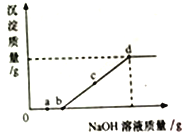
A. a点溶液中滴入紫色石蕊试液变红
B. bc段(不含b点)反应的化学方程式为:MgCl2+2NaOH==Mg(OH)2↓+2NaCl
C. 整个变化过程中氯离子数目没有改变
D. d点溶液中含有两种溶质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向200gAgNO3溶液中加入m克Fe和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得21.6g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是( )
A.滤液的质量是178.4g
B.混合粉末的质量范围是5.6g<m<6.4g
C.固体中加入稀盐酸可能会有气体生成
D.原AgNO3溶液的溶质质量分数是17%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是初中化学中的一些基本实验操作:
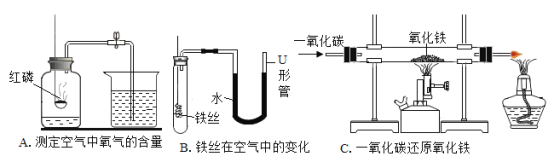
(1)装置A中发生反应的化学方程式为_____,红磷需稍过量的目的是_____;红磷能用于测定空气中氧气的含量,除了燃烧产物为固体外,还因为_____。
(2)装置B探究铁丝在空气中的变化,一段时间后,观察到U形管_____(填“左边”或“右边”)的水面上升。
(3)装置C中硬质玻璃管内的实验现象为_____,发生反应的化学方程式为_____,装置末端酒精灯的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图.回答下列问题:
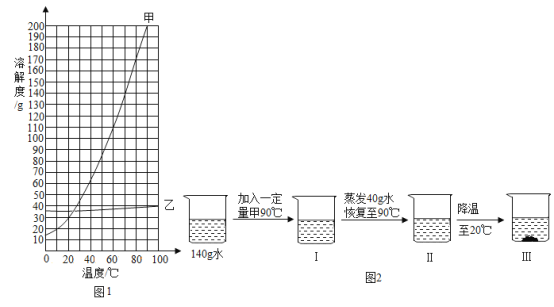
①在10℃时,甲、乙两种物质的溶解度大小关系为_____。
②某温度下,将甲的不饱和溶液转化为饱和溶液的方法之一是_____。
③甲物质中含有少量乙物质时,提纯甲的方法是_____。
④取一定量的甲物质和水进行如图2所示操作:若Ⅲ中析出116g固体(不含结晶水),则加入甲的质量是_____g; 下列对上述过程的分析正确的是_____。
A Ⅰ中溶液为不饱和溶液
B Ⅱ中溶液可能是饱和溶液
C 开始析出固体甲的温度在 70℃至 80℃之间
D 烧杯中溶液的溶质质量分数是Ⅱ>Ⅲ>Ⅰ
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
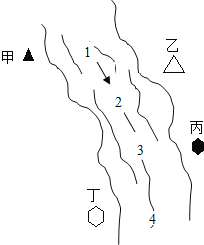
① | ② | ③ | ④ | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com