

| ||
| 1 |
| 5 |
| ||


科目:初中化学 来源: 题型:
| A、丙氨酸中氮元素质量分数为25.8% |
| B、丙氨酸的相对分子质量为89 |
| C、丙氨酸中碳、氢、氧、氮各元素的质量比为36:7:32:14 |
| D、丙氨酸分子中氮原子与氧原子的个数比1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、为了避免水体污染,农业上应合理使用农药和化肥 |
| B、饮用硬水不利于健康,要将硬水进行软化 |
| C、水的天然循环能实现水的从新分配,不需兴建水利工程 |
| D、农业生产中用喷灌或滴灌的方法给农作物浇水,可节约用水 |
查看答案和解析>>
科目:初中化学 来源: 题型:
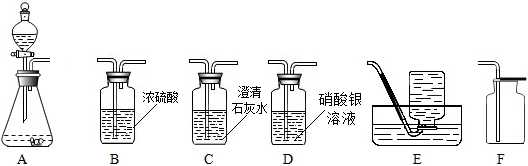
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

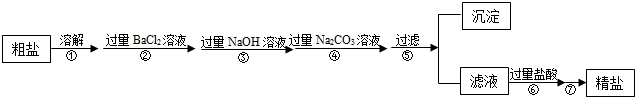

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com