
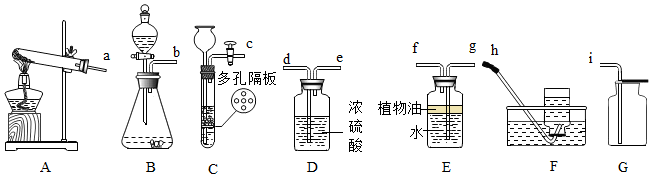
分析 锥形瓶是常用的反应容器,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.若用E装置收集氨气,其中花生油的作用是:防止氨气溶于水,因为氨气极易溶于水.
解答 解:(1)锥形瓶是常用的反应容器,故答案为:锥形瓶;
(2)如果用双氧水和二氧化锰制氧气就不需要加热,氧气可以用浓硫酸干燥,并且长进短出,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用向上排空气法收集的氧气比较干燥,故答案为:bedi;
(3)碳酸钠粉末与稀盐酸反应生成氯化钠和水和二氧化碳,配平即可;该反应速率过快不易收集气体,为了得到平稳的气流便于收集,选择的最佳发生装置为B,因为分液漏斗可以控制反应的速率,故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;B;
(4)若用E装置收集氨气,其中花生油的作用是:防止氨气溶于水,因为氨气极易溶于水,故答案为:防止氨气溶于水;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


科目:初中化学 来源: 题型:选择题
| A. | 二氧化氮 | B. | 二氧化硫 | C. | PM2.5 | D. | 氮气 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 向稀硫酸中滴加石蕊溶液,溶液变蓝 | |
| B. | 打开盛有浓硫酸试剂瓶的瓶塞,在瓶口上方出现大量白雾 | |
| C. | 硫在氧气中燃烧产生蓝紫色火焰、放热、生成有刺激性气味的气体 | |
| D. | 氧化钙放入水中,溶液温度升高 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 选项 | 实验目的 | 实验操作 |
| A | 验证某可燃性气体中含有H2 | 点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁是否出现液滴 |
| B | 除去NaCl中的Na2SO4 | 加水溶解,再加过量BaCl2溶液后过滤、蒸发、结晶 |
| C | 鉴别化肥KNO3和NH4Cl | 取样与熟石灰混合研磨,闻气味 |
| D | 检验NaOH是否变质 | 加水溶解,滴加足量的稀盐酸,观察是否产生气泡等(合理即可) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
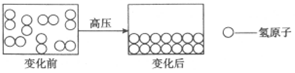 据报道,科学家成功用气态(或液态)氢在上百万大气压的高压下制成具有金属性质的金属氢(如图所示).下列判断中不正确的是( )
据报道,科学家成功用气态(或液态)氢在上百万大气压的高压下制成具有金属性质的金属氢(如图所示).下列判断中不正确的是( )| A. | 该变化过程属于化学变化 | B. | 以上物质均为单质 | ||
| C. | 金属氢和氢气的密度相同 | D. | 金属氢可以导电 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 现象 | 微观解释 |
| A | 两块表面平滑的铅块紧压后会结合起来 | 分子间存在引力 |
| B | 尘土飞扬 | 分子在不断运动 |
| C | 食物腐烂 | 分子本身发生变化 |
| D | 敞口放置的盐酸变稀 | 分子在不断运动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
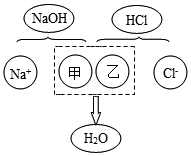 某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:
某化学兴趣小组同学向一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸,反应中溶液pH的变化记录如下,根据表中数据分析:| 加入盐酸的体积 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液pH | 12.5 | 10.8 | 9.7 | 8.5 | 7.0 | 6.2 | 5.3 | 4.2 | 3.1 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com