
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液________________;乙溶液________________;丙溶液________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
答案 (1)①正 ②4OH--4e-===2H2O + O2↑
③2.8 ④16 ⑤pH增大 pH减小 pH不变
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。
解析 (1)①乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中电解液为K2SO4溶液,相当于电解水,设电解的水的质量为x g。由电解前后溶质质量相等有,100×10%=(100-x)×
10.47%,得x=4.5 g,故电解的水为0.25 mol。由方程式2H2O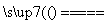 2H2↑+O2↑可知,电解
2H2↑+O2↑可知,电解
2 mol H2O,转移4 mol电子,所以整个反应中转移了0.5 mol电子,而整个电路是串联的,故每个烧杯中的电极上转移的电子数是相等的。②甲中为NaOH溶液,相当于电解水,阳极b处为阴离子OH-放电,即4OH--4e-===2H2O+O2↑。③转移0.5 mol电子,则生成O2为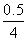 mol=0.125 mol,标况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。④Cu2++2e-===Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2 mol×64 g·mol-1=16 g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4溶液,有电解液即可电解。
mol=0.125 mol,标况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。④Cu2++2e-===Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2 mol×64 g·mol-1=16 g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4溶液,有电解液即可电解。


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:初中化学 来源: 题型:
验证镁、锌、银的金属活动性,可选择的试剂是 ( )
A.银、硫酸锌溶液及硫酸镁溶液 B.镁、银和硫酸锌的溶液
C. 镁、锌和硝酸银溶液 D._______________
查看答案和解析>>
科目:初中化学 来源: 题型:
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO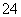 )>c(NH
)>c(NH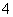 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:初中化学 来源: 题型:
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为Fe-2e-===Fe2+
B.正极发生的反应为2H2O+O2+2e-===4OH-
C.原电池是将电能转化为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
查看答案和解析>>
科目:初中化学 来源: 题型:
元素周期律产生的根本原因就是随着元素原子序数的递增
( )。
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.原子半径呈周期性变化
D.元素主要化合价呈周期性变化
查看答案和解析>>
科目:初中化学 来源: 题型:
在恒温、体积为2 L的密闭容器中进行反应:2A(g)3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
A.v(B)=0.03 mol·L-1·s-1
B.v(B)=0.045 mol·L-1·s-1
C.v(C)=0.03 mol·L-1·s-1
D.v(C)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:初中化学 来源: 题型:
下列热化学方程式中ΔH表示可燃物标准燃烧热的是( )
A.CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
D.H2(g)+Cl2(g)===2HCl(g)
ΔH=-184.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com