
| A. | 铁 | B. | 氯化钡溶液 | C. | 硫酸铜溶液 | D. | 氧化铜 |
分析 根据氢氧化钠与硫酸反应的化学方程式即可知道两者反应后硫酸完全反应,氢氧化钠有剩余;由此得出反应后溶液的溶质有NaOH和Na2SO4;然后根据选项中的物质与NaOH和Na2SO4反应的情况选择即可.
解答 解:设参加反应的NaOH的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 10g×20%
$\frac{80}{x}=\frac{98}{10g×20%}$
解之得:x≈1.63g<10g×20%,
故硫酸溶液被反应完,氢氧化钠溶液有剩余.
所以反应后所得溶液中有NaOH和Na2SO4,它们与金属铁及氧化铜不能发生反应,与氯化钡,硫酸铜反应都能生成沉淀.
故选AD.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


 小学课时特训系列答案
小学课时特训系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  向一定量硫酸铜溶液中逐渐放入铁粉 向一定量硫酸铜溶液中逐渐放入铁粉 | |
| B. | 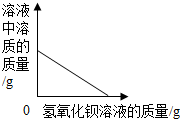 向一定量稀硫酸中加入氢氧化钡溶液至恰好中和 向一定量稀硫酸中加入氢氧化钡溶液至恰好中和 | |
| C. |  向一定量大理石(杂质不参加反应)中滴加稀盐酸 向一定量大理石(杂质不参加反应)中滴加稀盐酸 | |
| D. | 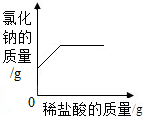 向一定量氯化钠和碳酸氢钠混合物中滴加稀盐酸 向一定量氯化钠和碳酸氢钠混合物中滴加稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶质 | H2S04 | HCl | H2S | H2C03 | HClO |
| PH | 小→大 | ||||
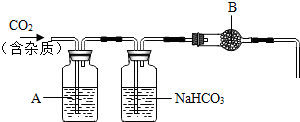
| 实验步骤 | I.将适量盐酸加入烧杯中并称重 | Ⅱ.称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | Ⅲ.待反应完全后,称重 |
| 实验图示 | 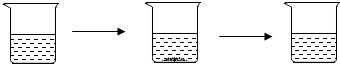 | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 如图是“×××”补钙剂商品标签图.我能根据标签信息完成下列问题:
如图是“×××”补钙剂商品标签图.我能根据标签信息完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子的运动速率随温度的升高而加快 | |
| B. | 分子在不停地做无规则运动 | |
| C. | 分子的质量和体积都很小 | |
| D. | 分子之间有间隔 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
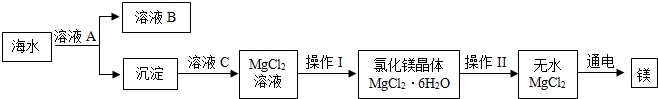
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com