
分析 (1)根据氢氧化钠会与氯化镁反应生成沉淀进行分析;
(2)根据碳酸钠会与氯化钙反应生成转化为沉淀进行分析;
(3)根据加入的氢氧化钠、碳酸钠都是过量的,会对氯化钠造成影响进行分析;
(4)根据题中各物质之间的反应进行分析.
解答 解:(1)氢氧化钠会与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入过量的氢氧化钠溶液,其主要目的是:除去氯化镁;
(2)碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,所以加入过量的碳酸钠溶液,目的是除去粗盐中的氯化钙;
(3)加入的氢氧化钠、碳酸钠都是过量的,会对氯化钠造成影响,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠和盐酸反应生成氯化钠和水,所以向滤液中加入适量盐酸,目的是:除去反应中过量的氢氧化钠和碳酸钠;
(4)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故答案为:(1)除去氯化镁;
(2)氯化钙;
(3)除去反应中过量的氢氧化钠和碳酸钠;
(4)Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评 本题主要对物质的除杂和净化进行了探究,在除杂质的同时不要引入新的杂质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 高层住房内着火,立即打开所有门窗 | |
| B. | 电器着火,立即用水扑灭 | |
| C. | 油锅着火,立即盖上锅盖 | |
| D. | 煤气泄露,立即打开排气扇的电源开关 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
| pH | 1~3 | 4~5 | 6~7 | 8~10 | 11~14 |
| A. | 由紫到绿 | B. | 由绿到蓝 | C. | 由橙到绿 | D. | 由红到紫 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 实验目的 | 主要实验操作 | |
| A | H2O和H2O2 | 鉴别 | 加入适量二氧化锰,观察是否有气泡产生 |
| B | MnO2(KCl) | 分离 | 溶解、过滤、蒸发 |
| C | CO2(H2O) | 干燥 | 将气体通过碱石灰(主要成分氢氧化钠)干燥管 |
| D | NaOH、Ca(OH)2 | 除杂 | 加入适量Na2CO3溶液,充分反应后,过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
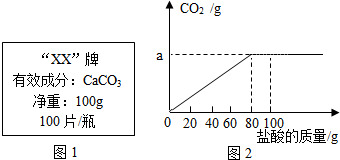 钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.| 第1次 | 第2次 | 第3次 | 第4次 | 第五次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | 30 | m | 20 | n |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
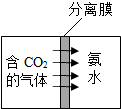
 ,则X=8.
,则X=8.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
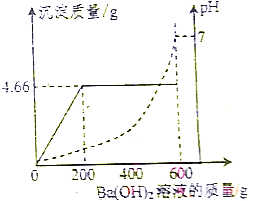 为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴加入某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示.
为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴加入某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com