
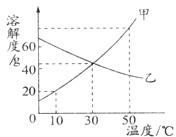
 <1>生活中蕴含科学,留心处皆学问.请用下列序号填空:
<1>生活中蕴含科学,留心处皆学问.请用下列序号填空: 2Na+3N2↑.
2Na+3N2↑. 2Na+3N2↑;
2Na+3N2↑;

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
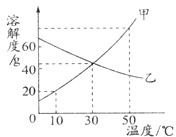 <1>生活中蕴含科学,留心处皆学问.请用下列序号填空:
<1>生活中蕴含科学,留心处皆学问.请用下列序号填空:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2011届山西省山西大学附中初三3月份月考化学试卷 题型:填空题
生活中蕴含科学,留心处皆学问。现有以下常见的物质:①SO2、②C2H5OH、③NaOH、④NaCl、⑤C、⑥CH3COOH。请选择合适物质的序号填空:
(1)俗称烧碱的是 。
(2)医疗上用来配制生理盐水的是 。
(3)属于空气污染物之一的是 。
(4)可用作干电池电极的是 。
(5)食醋中含有的酸是 。
(6)可用作酒精灯燃料的是 。
查看答案和解析>>
科目:初中化学 来源:2011年山东省潍坊市诸城市繁华中学中考化学模拟试卷(五)(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com