

| ||
| ||
| ||


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验 编号 | 试剂 | 前9min内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和质量分数的稀硫酸 | ||
| a | 纯锌 | 30mL30% | 564.3 |
| b | 含杂质的锌 | 30mL30% | 634.7 |
| c | 纯锌 | 30mL20% | 449.3 |
| d | 纯锌 | 40mL30% | 602.8 |

| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 33.1mL | 116.7mL | 91.9mL | 89.6mL | 77.6mL | 56.0mL |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、①② | B、③④ |
| C、①③④ | D、①②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:
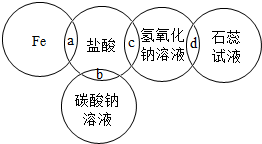 如图两圆相交部分是五种物质中两两之间相互反应的示意图.下列对反应现象的说法中,错误的是( )
如图两圆相交部分是五种物质中两两之间相互反应的示意图.下列对反应现象的说法中,错误的是( )| A、a处形成浅绿色溶液 |
| B、b处形成大量气泡 |
| C、c处反应生成氯化钠 |
| D、d处溶液呈红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com