【答案】
分析:(1)依据铝易在空气中形成氧化铝的保护膜分析解答;
(2)依据铁生锈的条件以及常用的控制铁生锈的方法解决;
(3)依据炼铁是采用氧化铁与一氧化碳反应的事实分析书写即可;
(4)①依据三者与盐酸反应的速度及情况分析解答;
②依据氢前金属能与稀酸反应生成氢气,而活动性强的金属能从盐溶液中置换出活动性比它弱的金属,据此分析设计即可;
③以及金属活动性顺序的应用分析解答即可;
解答:解:(1)铝制品具有很好的耐腐蚀性能,主要是因为铝易在空气中与氧气反应形成了氧化铝的保护膜,从而能阻止铝的继续氧化;
(2)铁生锈的条件是水与氧气共存的条件下,所以只要控制了生锈的条件就可阻止铁的生锈,常用的方法有涂油(或镀其他金属、刷漆等其他防锈方法);
(3)炼铁是采用氧化铁与一氧化碳反应生成单质的铁与二氧化碳,其方程式为:Fe
23+3C0
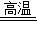
2Fe+3CO
2;
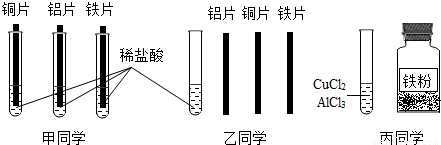
(4)①三者与盐酸反应的速度及情况不同:铜不会与盐酸反应,而或铝片和铁片表面都有气泡产生,且铝比铁反应剧烈;
②由于氢前金属能与稀酸反应生成氢气,而活动性强的金属能从盐溶液中置换出活动性比它弱的金属,所以可以先放入铁,则能生成氯化亚铁和氢气,再放入铜不能置换出铁,而后放入铝能置换出铁,所以可知三者的活动性是Al>Fe>Cu;也可先放入铜,不会与酸反应再放入铁能反应并生成氢气,最后放入铝则铝能置换出氯化亚铁中的铁,也可证明三者的活动性,据此方法与原理可知以下方案可完成三者金属活动性的顺序:Fe、Cu、Al(或Cu.Fe、Al)(名称也可) Cu、Fe、Al(或Fe、Cu、Al)(名称也可),其方程式可依据设计的情况完成;
③向滤出的固体中加入稀盐酸,无明显现象,说明固体中没有铁和铝,所以可知溶液中一定存在氯化铝和氯化亚铁;
故答案为:(1)铝易与氧气反应,在其表面形成一层致密的氧化铝薄膜,阻止铝进一步被氧化;
(2)与氧气和水(或水蒸气)接触 涂油(或镀其他金属、刷漆等其他防锈方法);
(3)Fe
23+3C0
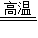
2Fe+3CO
2;
(4)①铝片表面比铁片表面产生气泡快(或铝片和铁片表面都有气泡产生,且铝比铁反应剧烈);②Fe、Cu、Al(或Cu.Fe、Al)(名称也可) Cu、Fe、Al(或Fe、Cu、Al)(名称也可);Fe+2HCl=FeCl
2+H
2↑(或3FeCl
2+2A1=2AlCl
3+3Fe);③FeCl
2、AlCl
3(或氯化亚铁、氯化铝);
点评:本题考查学生对于金属活动性顺序的探究,我们可以把这类题目归结为“明知故问”型的题目,我们在解答该类题目时就是根据已经掌握的金属活动性顺序,然后对所给的加入金属的顺序结合金属活动性顺序的应用来解答.

 2Fe+3CO2;
2Fe+3CO2;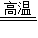 2Fe+3CO2;
2Fe+3CO2;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案




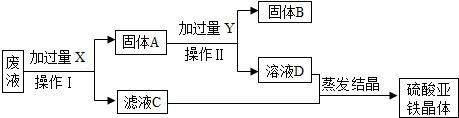

 铝、铁、铜是我们生活中常见的金属.
铝、铁、铜是我们生活中常见的金属.