
| 实验装置 | 实验步骤及操作 | 实验现象 |
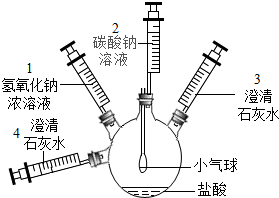 | ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生. | 气球变瘪 |
| ②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
| ③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
| 无明显现象 | ||
| ⑤将注射器4中的溶液推入瓶中 |
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 | A中产生白色沉淀,B中没有沉淀 | 瓶内溶液中溶质的成分为 |
| 实验操作 | 实验现象 | 实验结论 |
| NaOH、NaCl 和 Na2CO3 |


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
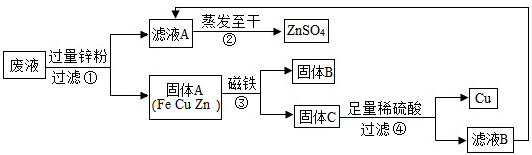
查看答案和解析>>
科目:初中化学 来源: 题型:
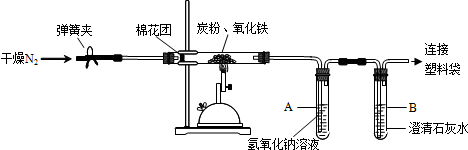
查看答案和解析>>
科目:初中化学 来源: 题型:
| +1 |
| H |
查看答案和解析>>
科目:初中化学 来源: 题型:
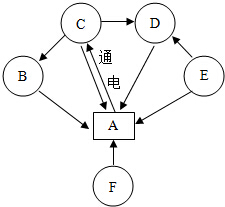 A、B、C、D、E、F是初中化学常见物质,转化关系如图(其中部分生成物和反应条件已略):已知B、F为金属氧化物,B溶于酸会得到蓝色溶液,F中的金属元素是地壳中含量最高的金属元素;E是天然气的主要成分,请回答下列问题:
A、B、C、D、E、F是初中化学常见物质,转化关系如图(其中部分生成物和反应条件已略):已知B、F为金属氧化物,B溶于酸会得到蓝色溶液,F中的金属元素是地壳中含量最高的金属元素;E是天然气的主要成分,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
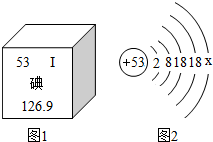 阅读下列两段材料,回答问题:
阅读下列两段材料,回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com