
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
科目:初中化学 来源: 题型:
已知下列热化学方程式:
①H2(g)+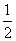 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+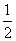 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+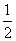 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是__________________________________________。
(2)H2的燃烧热为________;C的燃烧热为________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
| 活性炭 | NO(mol) | A(mol) | B(mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)该反应方程式为_______________________________________________________。
(2)在T1 ℃下反应达到平衡后,下列措施能改变NO的转化率的是________(填字母序号)。
a.增大活性炭的量 b.增大压强
c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为____________________________________(生成物A、B用相应的化学式表示)。若T1 ℃时的平衡常数为K1,T2 ℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理由_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
在一密闭烧瓶中,在25 ℃时存在如下平衡:2NO2(g)N2O4(g) ΔH<0,将烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强
⑤密度
A.①和③ B.②和④
C.④和⑤ D.③和⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:初中化学 来源: 题型:
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O
D.正极上发生的反应为O2+4e-+2H2O===4OH-
查看答案和解析>>
科目:初中化学 来源: 题型:
航天技术中使用的氢氧燃料电池具有高能、轻便和无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为____________________________________________;
碱式电池中的电解质是碱,其正极反应式为O2+2H2O+4e-===4OH-,则其负极反应可表示为________________________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
甲、乙两种物质的溶解度曲线如下图所示,下列说法中正确的是( )。

A.30 ℃时,50 g水可以溶解25 g甲物质
B.升温能使甲物质的不饱和溶液变为饱和溶液
C.20 ℃时,甲、乙两种物质的溶解度相同
D.30 ℃时,乙物质的溶解度比甲物质的溶解度大
查看答案和解析>>
科目:初中化学 来源: 题型:
以下是探究Cu、Fe、Ag三种金属活动性顺序的实验过程,请回答问题:
(1)将铜丝和铁丝分别放入相同浓度的稀硫酸中,依据__________________现象,证明Fe的活动性比Cu强;
(2)将铜丝放入AgNO3溶液中,或向Cu(NO3)2溶液中放入金属________,都能证明Cu的活动性比Ag强。
结论:三种金属的活动性顺序是Fe>Cu>Ag
Cu与AgNO3溶液反应的化学方程式为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com