
| A. | 将50g溶质质量分数10%的稀盐酸加热蒸发25g水,得到溶质质量分数小于20%的盐酸 | |
| B. | 用50mL水和50mL酒精配制成100mL酒精溶液 | |
| C. | 用pH试纸测得某溶液的pH为3.12 | |
| D. | 已知20℃时氯化钠的溶解度为36g,在此温度下,将50g氯化钠固体放入50g水中,可配成质量分数为50%的氯化钠溶液 |
分析 A、依据盐酸加热会挥发出氯化氢气体判断;
B、根据分子间有间隔进行分析判断.
C、pH试纸用于粗略测定酸碱度,测的pH只能为整数.
D、由20℃时,氯化钠的溶解度是36g;则可判断在20℃时,50g水中最多溶解氯化钠的质量.
解答 解:A、盐酸加热蒸发水时随着水分的蒸发会挥发出氯化氢气体,所以溶质质量分数会小于20%;
B、由于分子间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,用50mL水和50mL纯酒精混合配制成的酒精溶液小于100mL,故选项实验操作中不能达到预期目的.
碳酸钙难溶于水,不能与活性炭反应,不能用于制取纯净的二氧化碳,故选项实验操作中不能达到预期目的.
C、pH试纸用于粗略测定酸碱度,测的pH只能为整数不能为3.12,故选项实验操作中不能达到预期目的.
D、20℃时,氯化钠的溶解度是36g,因此在20℃时,设50g水中最多能溶解氯化钠的质量为:x,则:36:100=x:50,解得x=18g,故不可配成质量分数为50%的氯化钠溶液,故选项实验操作中不能达到预期目的.
故选:A.
点评 本题难度不大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.


科目:初中化学 来源: 题型:解答题





查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Q1 | B. | $\frac{40a{Q}_{1}}{49b}$ | C. | $\frac{49a{Q}_{1}}{40b}$ | D. | $\frac{40b{Q}_{1}}{49a}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定含有Na2CO3,一定没有Na2SO4,可能含有NaOH、NaCl | |
| B. | 一定含有Na2CO3,一定没有Na2SO4、NaOH,可能含有NaCl | |
| C. | 一定含有NaOH、Na2CO3,一定没有Na2SO4,可能含有NaCl | |
| D. | 一定含有Na2CO3、NaCl、NaOH,一定没有Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Zn | B. | ZnO | C. | Zn(OH)2 | D. | ZnCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 9.06 | B. | 23.40 | C. | 12.87 | D. | 10.53 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
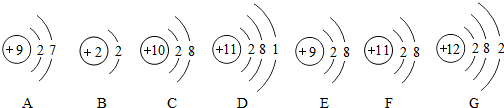
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
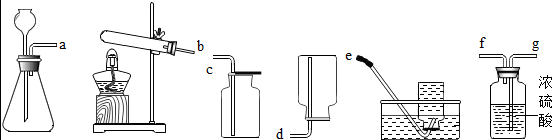
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com