
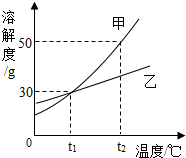
| A. | tl℃时,100g甲溶液中含甲物质的质量小于30g | |
| B. | tl℃时,甲和乙的溶解度相同 | |
| C. | t2℃时,等质量的甲、乙的饱和溶液降温到tl℃时析出晶体甲大于乙 | |
| D. | t2℃时,甲的饱和溶液溶质质量分数为50% |
分析 根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的变化比乙大;tl℃时,甲的溶解度是30g,因此100g甲溶液中含甲物质的质量小于30g正确;tl℃时,甲和乙的溶解度相同正确,因为在该温度下,它们有交点;t2℃时,等质量的甲、乙的饱和溶液降温到tl℃时析出晶体甲大于乙正确,因为甲的溶解度随温度的变化比乙大;t2℃时,甲的溶解度是30g,因此甲的饱和溶液溶质质量分数=$\frac{30g}{130g}×100%≈23.1%$,不是50%.
解答 解:A、tl℃时,甲的溶解度是30g,因此100g甲溶液中含甲物质的质量小于30g正确,正确但不符合题意,故选项错误;
B、tl℃时,甲和乙的溶解度相同正确,因为在该温度下,它们有交点,正确但不符合题意,故选项错误;
C、t2℃时,等质量的甲、乙的饱和溶液降温到tl℃时析出晶体甲大于乙正确,因为甲的溶解度随温度的变化比乙大,正确但不符合题意,故选项错误;
D、t2℃时,甲的溶解度是30g,因此甲的饱和溶液溶质质量分数=$\frac{30g}{130g}×100%≈23.1%$,不是50%,错误符合题意,故选项正确;
故选D
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量过氧化钠粉末于试管中,加入蒸馏水,再用带火星的木条伸入试管中 | 木条复燃 | 过氧化钠能与水反应生成氧气 |
| ②向上述反应后的试管中滴加酚酞试液 | 溶液变红 | 所得溶液呈碱性,推断过氧化钠与水反应生成NaOH NaOH(填化学式) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
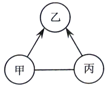 如图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物.胃液中含有适量的甲,可帮助消化.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系(如H2O→H2,部分反应物、生成物已略去).
如图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物.胃液中含有适量的甲,可帮助消化.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系(如H2O→H2,部分反应物、生成物已略去).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | |
| 所取固体样品的质量/g | 20 | 10 | 10 |
| 加入AgNO3溶液的质量/g | 100 | 100 | 150 |
| 反应后所得沉淀的质量/g | 14.35 | 14.35 | 14.35 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com