
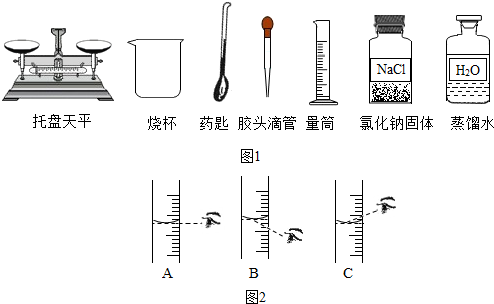
分析 【提出猜想】根据碳酸钠溶液与氯化钡溶液反应生成碳酸钡沉淀和氯化钠,在反应过程中,如果二者恰好完全反应,则滤液中的溶质只有NaCl;若Na2CO3有剩余,则溶液中的溶质除了NaCl还有Na2CO3;若BaCl2有剩余,则溶液中的溶质除了NaCl还有BaCl2进行分析;
【实验探究】
(1)根据【查阅资料】可知:碳酸钠溶液显碱性,氯化钠、氯化钡溶液显中性,酚酞是一种酸碱指示剂,遇碱变红,遇酸不变色;由于“取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象”说明滤液里面没有碱性的物质进行分析;
(2)根据结论是猜想2成立,也就是证明滤液中溶质有:NaCl还有BaCl2,加入Na2CO3溶液后,碳酸钠溶液与氯化钡溶液反应生成碳酸钡沉淀和氯化钠,可观察到有白色的碳酸钡沉淀生成进行分析;
【问题讨论】(3)根据证明滤液中溶质有:NaCl还有BaCl2,加入AgNO3溶液后,NaCl和BaCl2都能和AgNO3反应生成沉淀进行分析
解答 解:【提出猜想】碳酸钠溶液与氯化钡溶液反应生成碳酸钡沉淀和氯化钠,在反应过程中,如果二者恰好完全反应,则滤液中的溶质只有NaCl;若Na2CO3有剩余,则溶液中的溶质除了NaCl还有Na2CO3;若BaCl2有剩余,则溶液中的溶质除了NaCl还有BaCl2;
【实验探究】
(1)由【查阅资料】可知:碳酸钠溶液显碱性,氯化钠、氯化钡溶液显中性,酚酞是一种酸碱指示剂,遇碱变红,遇酸不变色,由于“取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象”说明滤液里面没有碱性的物质,由题意可知:溶液中没有显碱性的碳酸钠;同学们认为猜想3不成立;
(2)由于结论是猜想2成立,也就是证明滤液中溶质有:NaCl还有BaCl2,加入Na2CO3溶液后,碳酸钠溶液与氯化钡溶液反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl;可观察到有白色沉淀生成;
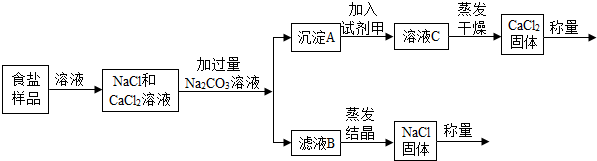
【问题讨论】(1)证明滤液中溶质有:NaCl还有BaCl2,加入Na2SO4溶液后,硫酸钠溶液与氯化钡溶液反应生成硫酸钡沉淀和氯化钠,反应的化学方程式为:Na2SO4+BaCl2═BaSO4↓+2NaCl;可观察到有白色沉淀(BaSO4)生成;所以甲同学能达到实验目的;
(2)证明滤液中溶质有:NaCl还有BaCl2,加入AgNO3溶液后,NaCl和BaCl2都能和AgNO3反应生成沉淀.NaCl和AgNO3反应生成氯化银和硝酸钠,化学方程式为:NaCl+AgNO3═AgCl↓+NaNO3;BaCl2和AgNO3反应生成氯化银和硝酸钡,化学方程式为:BaCl2+2AgNO3═2AgCl↓+Ba(NO3)2;无法证明溶液中含有BaCl2;所以乙同学不能达到实验目的,理由是:氯化钠和硝酸银反应也能够生成白色沉淀.
故答案为:【提出猜想】Na2CO3;
【实验探究】
(1)3;
(2)白色沉淀生成;
【问题讨论】
(3)氯化钠和硝酸银反应也能够生成白色沉淀.
点评 本题考查的重点是根据实验现象判断物质的存在情况,由此可知认真观察实验现象的重要性,要养成良好的观察习惯.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 燃烧是一种缓慢的氧化反应 | |
| B. | 高楼发生火灾,应该跳楼逃生 | |
| C. | 扑灭大火,最适宜的灭火器是液态二氧化碳灭火器 | |
| D. | 在火场的浓烟中逃生,可用湿毛由后住口鼻,低姿势前行 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
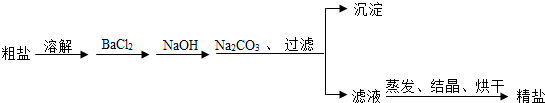
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
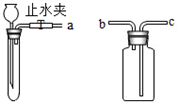 实验室可通过连接如图装置制取二氧化碳、氧气等.
实验室可通过连接如图装置制取二氧化碳、氧气等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com